
 2NH3(g)������������ʵ�飬���з�ӦH2(g)+I2(g)
2NH3(g)������������ʵ�飬���з�ӦH2(g)+I2(g)  2HI(g) ?H=-akJ?mol��1,ʵ����������ʼͶ�����±���ʾ�����½�����ȷ����
2HI(g) ?H=-akJ?mol��1,ʵ����������ʼͶ�����±���ʾ�����½�����ȷ����
| A�������У���ƽ��ʱN2��NN3��ת���ʷֱ�Ϊ��1 �ͦ�2�����1 +��2=1 |
| B�������У�ƽ�����NH3��Ũ����ƽ���Ķ��� |
| C�������У�����ƽ��ʱ���з���Q1kJ, ��������Q2kJ����Q1+Q2=a |
| D�������У���ƽ������ʱ�䣺��С�ڢ� |


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д� �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� | X | Y | Z |
| ��ʼŨ��/mol��L��1 | 0.1 | 0.2 | 0 |
| ƽ��Ũ��/mol��L��1 | 0.05 | 0.05 | 0.1 |
 2 Z����ƽ�ⳣ��Ϊ1600
2 Z����ƽ�ⳣ��Ϊ1600�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
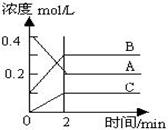
 C��g��+D��g�����ڲ�ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ���Իش��������⣺
C��g��+D��g�����ڲ�ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ���Իش��������⣺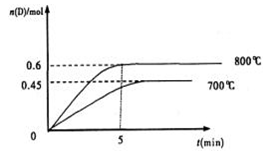
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 N2O4(g) ��H��0 ����ƿ����100���ˮ�У��ֽ����µ�ƽ��״̬��ǰ����ƽ��Ƚϣ�������ǣ� ��
N2O4(g) ��H��0 ����ƿ����100���ˮ�У��ֽ����µ�ƽ��״̬��ǰ����ƽ��Ƚϣ�������ǣ� ��| A����ɫ���� | B��ƽ������������ | C�����ʵ������� | D���ܶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3(g) ��H<0����֪c(SO2)ʼ=0.4mol/L��c(O2)ʼ=1mol/L���ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K��19�����жϣ�
2SO3(g) ��H<0����֪c(SO2)ʼ=0.4mol/L��c(O2)ʼ=1mol/L���ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K��19�����жϣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�| |�¶�/ �� | 700 | 900 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
A(g)+B(g)��ƽ�ⳣ����ֵΪ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g) ��H��0��
2C(g) ��H��0���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO2��H2.����Ӧ�ﵽƽ��ʱ��CO���������Ϊx����ά��������������¶Ȳ��䣬��ʼ���ʰ�����������ȳ���������У��ﵽƽ��ʱCO�������������x����
CO2��H2.����Ӧ�ﵽƽ��ʱ��CO���������Ϊx����ά��������������¶Ȳ��䣬��ʼ���ʰ�����������ȳ���������У��ﵽƽ��ʱCO�������������x����| A��0.5 mol CO��2 mol H2O(g)��1 mol CO2��1 mol H2 |
| B��1 mol CO��1 mol H2O(g)��1 mol CO2��1 mol H2 |
| C��0.5 mol CO��1.5 mol H2O(g)��0.4 mol CO2��0.4 mol H2 |
| D��0.5 mol CO��1.5 mol H2O(g)��0.5 mol CO2��0.5 mol H2 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com