
| A. | 溴水、FeCl3溶液 | B. | 溴水、酸性KMnO4溶液 | ||
| C. | 溴水、Na2CO3溶液 | D. | FeCl3溶液、酸性KMnO4溶液 |
分析 己烯、苯酚分别与溴水反应的现象为溴水褪色、白色沉淀,甲苯能被高锰酸钾氧化,而己烷不能,以此来解答.
解答 解:A.溴水可鉴别己烯、苯酚,氯化铁不能检验甲苯、己烷,故A不选;
B.己烯、苯酚分别与溴水反应的现象为溴水褪色、白色沉淀,甲苯能被高锰酸钾氧化,而己烷不能,现象不同,可鉴别,故B选;
C.溴水可鉴别己烯、苯酚,Na2CO3溶液不能检验甲苯、己烷,故C不选;
D.FeCl3溶液可鉴别苯酚,酸性KMnO4溶液不能鉴别己烯、甲苯,故D不选;
故选B.
点评 本题考查有机物的鉴别,为高频考点,把握有机物的性质、有机反应与现象为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 甲 | BaCl2 | HCl | Cu(NO3)2 |
| 乙 | Fe2O3 | K2SO4 | H2SO4 |
| 丙 | Fe | NaOH | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
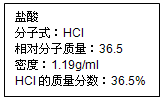 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 所含硫原子的物质的量之比为1:1 | B. | 硫元素的质量之比为5:4 | ||
| C. | 氧元素的质量之比为5:6 | D. | 所含氧原子的物质的量之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.42mol•L-1 | B. | 0.21mol•L-1 | C. | 0.56mol•L-1 | D. | 0.24mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将 100mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA | |
| B. | 通常状况下,0.5 mol锌粒与足量盐酸反应产生11.2 L H2 | |
| C. | 常温常压下,2.4g金属镁变成镁离子时,失去的电子数为0.1NA | |
| D. | 标准状况下,22.4L由N2和N2O组成的混合气体中,所含N原子的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4═2H++S6++4O2- | B. | HNO3═H++NO3- | ||
| C. | Ba(OH)2═Ba2++OH- | D. | Na2CO3═Na2++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com