
A、有机物B与 (M1=142.5)互为相邻同系物,则M(B)可能为128.5 (M1=142.5)互为相邻同系物,则M(B)可能为128.5 |
B、最简单的醛糖是甘油醛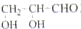 |
| C、苯和苯甲酸的混合物1mol,完全燃烧消耗O2的分子数为7.5NA |
| D、乙苯能被酸性KMnO4溶液氧化,是因为苯环对侧链上的-CH2-产生了影响,使其变活泼 |
 少一个CH2原子团,羟基直接连接在苯环上,为酚类物质,二者不是同系物,故A错误;
少一个CH2原子团,羟基直接连接在苯环上,为酚类物质,二者不是同系物,故A错误;| 6 |
| 4 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
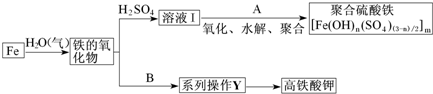
| 3-n |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
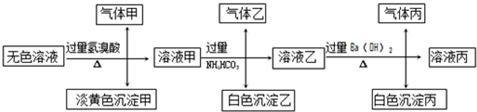
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | |||
| 2 | |||
| 3 | |||
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2
结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2| 酸性高锰酸钾溶液 |
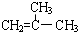 )为原料合成环状化合物F和高分子化合物E和G.
)为原料合成环状化合物F和高分子化合物E和G.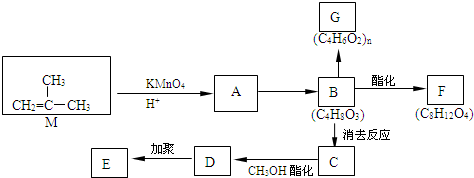
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
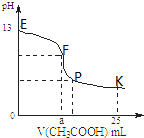 25℃时,在25mL0.1mol/L的NaOH溶液中逐渐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论不正确的是( )
25℃时,在25mL0.1mol/L的NaOH溶液中逐渐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论不正确的是( )| A、a=12.5,且混合溶液pH=7 |
| B、对应曲线上E、F间任何一点,溶液中都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C、P点时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
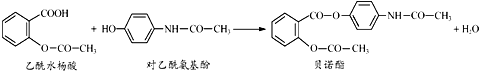
| A、贝诺酯分子中有两种含氧官能团 |
| B、可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C、乙酰水杨酸和对乙酰氨基酚均能与Na2CO3溶液反应 |
| D、贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
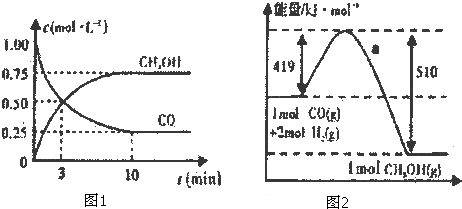
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com