考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)根据N原子序数,结合能量最低原则、泡利不相容原理和洪特规则,写出核外电子排布式,从而写出核外电子排布图;
(2)判断两种化合物均为离子晶体,利用离子晶体晶格能比较熔点;
(3)①反应中所含元素为:Na、N、O和H元素,根据第一电离能和电负性递变规律判断;
②根据NO
2-的杂化类型,判断其空间构型;
③根据N
2H
4中N原子成键数和孤对电子数判断杂化方式;H与N和O形成化学键时,彼此间容易形成氢键;
(4)根据晶胞结构计算出晶胞中所含微粒的数目,再根据密度和摩尔质量,计算出晶胞体积,从而得到晶胞边长,阴、阳离子之间的最近距离为晶胞边长的
倍.
解答:
解:(1)N原子序数为7,核外电子排布式为1s
22s
22p
3,根据洪特规则和泡利不相容原理,其核外电子排布图为

,故答案为:

;
(2)两种化合物均为离子晶体,晶格能越大,熔点越高,由于Li
+半径小于Na
+,晶格能较大,熔点高,故答案为:>;Li
+半径小,晶格能大,熔点高;
(3)①第一电离能同周期从左到右,呈增大趋势,由于N原子价电子半充满,比O原子稳定,第一电离能大于O;电负性,同周期从左到右,逐渐增大,电负性较强的为O原子,故答案为:N;O;
②NO
2-中N原子价电子对数为:
=3,形成三条杂化轨道,其中两条杂化轨道与O形成了两条共价键,一对孤对电子占据剩余的杂化轨道,其空间构型为V形,
故答案为:V形;
③N
2H
4中N原子与另一个N原子形成一条共价键,与两个氢原子形成两条共价键,共形成三条共价键,还有一对孤对电子占据一条杂化轨道,即共形成了4条杂化轨道,杂化类型为sp
3;一对孤对电子占据剩余的杂化轨道,其空间构型为V形,故答案为:V形;N-H键中的H原子可与其相邻的N-H键中的N原子形成氢键、可与O-H中的O原子形成氢键,O-H中的H原子可与相邻的O-H中的O原子形成氢键,也可和N-H键中的N原子形成氢键,故答案为:

;
(4)Li
+位于晶胞顶点和面心,数目为:2×
+8×
=2,N
3-位于面心,数目为:4×
=2,则一个晶胞质量为:
×2g,一个晶胞体积为:
cm
3,晶胞边长为:
cm=
×10
10pm,阴、阳离子之间的最近距离为晶胞边长的
倍,为
×
×1010pm,故答案为:
××1010.
点评:本题考查电子排布图、分子空间构型、杂化类型的判断以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法.

 LiN3与NaN3在军事和汽车安全气囊上有重要应用.
LiN3与NaN3在军事和汽车安全气囊上有重要应用. ,故答案为:
,故答案为: ;
; ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.
如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.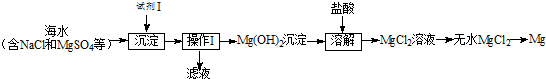
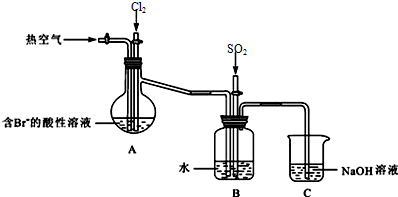
 据图回答下列问题:
据图回答下列问题:
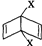 和
和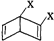 之外,还有多种同分异构体,
之外,还有多种同分异构体,