
【题目】设 NA为阿伏加德罗常数的值,下列说法不正确的是
A.2 mol SO2 和 1 mol O2 混合在 V2O5 存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA
B.某温度下纯水的 pH=6,该温度下 1L pH=11 的NaOH 溶液中含OH-的数目为 0.1NA
C.一定温度下,1 L 0.5 mol·L -1 NH4Cl 溶液与 2 L 0.25 mol·L -1NH4Cl 溶液含NH+均为 0.5NA
D.100 g CaCO3 与 KHCO3 的混合物中含有的阴离子的数目为 NA
【答案】C
【解析】
A. 2 mol SO2 和 1 mol O2 混合在 V2O5 存在的条件下于密闭容器中加热反应后,2SO2 + O2![]() 2SO3,由于反应是可逆反应,反应不完全,容器内物质分子数大于2NA,故A正确;
2SO3,由于反应是可逆反应,反应不完全,容器内物质分子数大于2NA,故A正确;
B. 某温度下纯水的pH=6,则Kw = 1×1012,该温度下1L pH=11的NaOH 溶液中c(H+)=1×1011molL1,则c(OH-)=1×101molL1,则n(OH-) = 1×101molL1×1L = 0.1mol,含OH-的数目为0.1NA,故B正确;
C. 一定温度下,1 L 0.5 mol·L -1 NH4Cl 溶液,n(NH4Cl)= 0.5molL1×1L = 0.5mol,2 L 0.25 mol·L -1NH4Cl 溶液,n(NH4Cl)= 0.25molL1×2L = 0.5mol,两者铵根水解程度不同,因此两者含NH+均不为 0.5NA,故C错误;
D. 100 g CaCO3 物质的量为1mol,含有的阴离子(CO32)数目为NA,100gKHCO3 物质的量为1mol,含有的阴离子(HCO3-)的数目为NA,故D正确;
综上所述,答案为C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用太阳能、风能、生物质能等可再生能源,转化利用二氧化碳设计出适合高效清洁的合成燃料分子结构,实现CO2+H2O→CxHy的分子转化,生产合成甲烷、醇醚燃料、烷烃柴油、航空燃油等可再生合成燃料。因此二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:
CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H1=-206.2kJ/mol
CH4(g)+H2O(g) △H1=-206.2kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) H2
CO2(g)+H2(g) H2
若CO2氧化H2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ,则△H2=__。
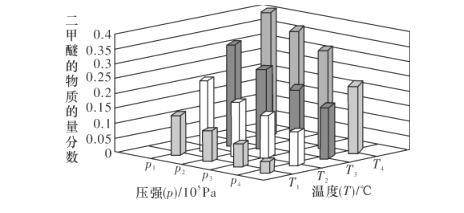
(2)合成二甲醚的总反应为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1。某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1__(填“>”“<"或“=”,下同)p2。若T3、p3,T4、p4时平衡常数分别为K3、K4则K3__K4,T1、p1时H2的平衡转化率为___。(结果保留三位有效数字)
CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1。某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1__(填“>”“<"或“=”,下同)p2。若T3、p3,T4、p4时平衡常数分别为K3、K4则K3__K4,T1、p1时H2的平衡转化率为___。(结果保留三位有效数字)
(3)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①该反应△H__(填“>”“<”或“=”)0。
②下列叙述能说明此反应达到平衡状态的是__(填字母代号)。
a.混合气体的平均相对分子质量保持不变
b.1molCO2生成的同时有3molH-H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
ω(CuO)% | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
CH3OH的产 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的质量分数为__催化效果最佳。
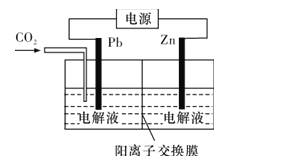
(4)CO2可用于工业制备草酸锌,其原理如图所示(电解液不参加反应),Zn电极是__极。已知在Pb电极区得到ZnC2O4,则Pb电极上的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种有机物分子中的碳原子数目相同,标准状况下烃A对氢气的相对密度是13;烃B跟HBr反应生成C;C与D混合后加入NaOH并加热,可生成B。
(1)写出有机物的结构简式:A____;D____。
(2)写出有关反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下步骤制取:
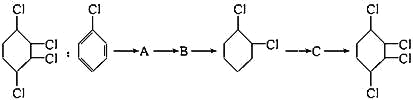
(1)从左到右依次填写每步所属的反应类型:(a.取代反应,b.加成反应,c.消去反应,只填字母)________________。
(2)A→B反应所需的试剂和条件是_______________________________。
(3)写出的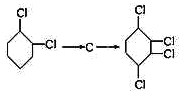 化学反应方程式:_____________________。
化学反应方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.10 mol/LKOH 溶液滴定 10.00mL 0.10 mol/L 某二元弱酸H2R 溶液,滴定曲线如图(混合溶液总体积看作混合前两种溶液体积之和),下列关系不正确的是
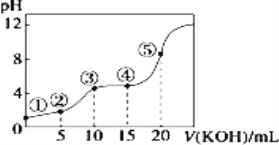
A.点②所示溶液中:c(K+)+c(H+)=c(HR-)+2c(R2-)+c(OH-)
B.点③所示溶液中:c(K+)> c(HR-)> c(R2-)>c(H2R)
C.点④所示溶液中:c(H2R)+ c(HR-)+ c(R2-)=0.04mol·L-1
D.点⑤所示溶液中:c(H+)= c(HR-)+2 c(H2R)+ c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH随温度的升高发生如下变化:

甲同学认为,该溶液pH升高的原因是随温度的升高HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为____________________。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3,该分解反应的化学方程式为_______________。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的BaCl2溶液,若产生沉淀,则乙判断正确。为什么?能不能选用Ba(OH)2溶液?_____________________________________________。
(2)将加热后的溶液冷却到10 ℃,若溶液的pH______(填“高于”、“低于”或“等于”)8.3,则__________(填“甲”或“乙”)判断正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
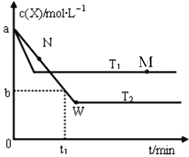
A. M点的 v正小于N点的v逆
B. M点时,升高温度平衡逆向移动
C. T2下,在0-t1时间内,v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
D. W点时再加入一定量Y,平衡后Y的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了如下3个实验方案,用以检验淀粉的水解程度:
(1)甲方案:淀粉液![]() 水解液
水解液![]() 中和液
中和液![]() 溶液变蓝
溶液变蓝
结论:淀粉尚未水解。
(2)乙方案:淀粉液![]() 水解液
水解液![]() 无银镜现象
无银镜现象
结论:淀粉尚未水解。
(3)丙方案:

结论:淀粉水解完全。
上述三个方案操作是否正确?说明理由。_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com