
【题目】常温下,用 0.10 mol/LKOH 溶液滴定 10.00mL 0.10 mol/L 某二元弱酸H2R 溶液,滴定曲线如图(混合溶液总体积看作混合前两种溶液体积之和),下列关系不正确的是
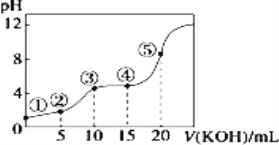
A.点②所示溶液中:c(K+)+c(H+)=c(HR-)+2c(R2-)+c(OH-)
B.点③所示溶液中:c(K+)> c(HR-)> c(R2-)>c(H2R)
C.点④所示溶液中:c(H2R)+ c(HR-)+ c(R2-)=0.04mol·L-1
D.点⑤所示溶液中:c(H+)= c(HR-)+2 c(H2R)+ c(OH-)
【答案】D
【解析】
A. 点②所示溶液中溶质为KHR 和H2R,两者浓度相同,根据溶液中电荷守恒得到c(K+) + c(H+) = c(HR-) + 2c(R2) + c(OH-),故A正确;
B. 点③所示溶液中溶质为KHR,溶液显酸性,电离为主,因此有c(K+)> c(HR-)> c(R2)> c(H2R),故B正确;
C. 点④所示溶液中溶质为KHR和K2R,两者浓度相同,溶液显酸性,电离为主,因此根据物料守恒得到:c(H2R)+ c(HR-)+ c(R2) =![]() ,故C正确;
,故C正确;
D. 点⑤所示溶液中溶质为K2R,根据质子守恒得到:c(OH-) = c(H+) + c(HR-) +2 c(H2R),故D错误。
综上所述,答案为D。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)![]() 3B+C ΔH>0,随着温度的升高,气体的平均相对分子质量有变小的趋势。下列关于B、C两种物质的聚集状态的判断不正确的是( )
3B+C ΔH>0,随着温度的升高,气体的平均相对分子质量有变小的趋势。下列关于B、C两种物质的聚集状态的判断不正确的是( )
A.B和C可能都是气体
B.B和C一定都是气体
C.若C为固体,则B一定是气体
D.有可能B为固体,C为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合物中可用分液漏斗分离,且有机物应从分液漏斗上口倒出的是 ( )
A.![]() 、Br2
、Br2
B.CH3Cl、H2O
C.CCl4、CHCl3
D.CH2Br—CH2Br、NaBr(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
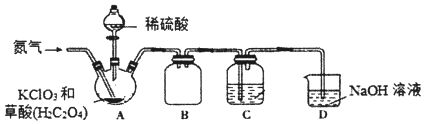
【题目】二氧化氯(C1O2)是一种黄绿色气体,沸点为11℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。C1O2易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照以下实验装置制备C1O2并验证其某些性质。
请回答下列问题:
(1)实验时A装置需要控制温度为60~80℃,则A装置加热的方式是___,该加热方式的优点是_____。
(2)通入氨气的主要作用有两个,一是可以起到搅拌作用,二是____。
(3)B装置的作用是___。C装置用来吸收C1O2,则C中液体易选用下列___(填序号)。
①热水 ②冰水 ③饱和食盐水
(4)装置D中C1O2与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中生成这两种钠盐的化学方程式为____。饱和NaClO2溶液在温度低于38℃时析出晶体NaC1O23H2O,在温度高于38℃时析出晶体NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.___;b.___;c.洗涤;d.干燥。
(5)设计一个简易实验证明二氧化氯具有永久的漂白性:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA为阿伏加德罗常数的值,下列说法不正确的是
A.2 mol SO2 和 1 mol O2 混合在 V2O5 存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA
B.某温度下纯水的 pH=6,该温度下 1L pH=11 的NaOH 溶液中含OH-的数目为 0.1NA
C.一定温度下,1 L 0.5 mol·L -1 NH4Cl 溶液与 2 L 0.25 mol·L -1NH4Cl 溶液含NH+均为 0.5NA
D.100 g CaCO3 与 KHCO3 的混合物中含有的阴离子的数目为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)煤气化制合成气(CO和H2)
已知:C(s)+H2O(g)===CO(g)+H2(g)ΔH2=131.3kJ·mol1
C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH2=90kJ·mol1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是_____
(2)由合成气制甲醇
合成气CO和H2在一定条件下能发生反应:CO(g)+2H2(g)![]() CH3OH(g)ΔH<0。
CH3OH(g)ΔH<0。
①在容积均为VL的甲、乙、丙、丁四个密闭容器中分别充入amolCO和2amolH2,四个容器的反应温度分别为T1、T2、T3、T4且恒定不变。在其他条件相同的情况下,实验测得反应进行到tmin时H2的体积分数如图所示,则T3温度下的化学平衡常数为_____(用a、V表示)
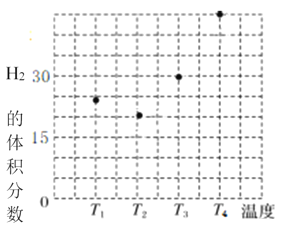
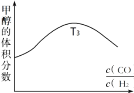
②图反映的是在T3温度下,反应进行tmin后甲醇的体积分数与反应物初始投料比![]() 的关系,请画出T4温度下的变化趋势曲线。______________
的关系,请画出T4温度下的变化趋势曲线。______________
③在实际工业生产中,为测定恒温恒压条件下反应是否达到平衡状态,可作为判断依据的是_____
A.容器内气体密度保持不变 B.CO 的体积分数保持不变
C.气体的平均相对分子质量保持不变 D.c(H2)=2c(CH3OH)
(3)由甲醇制烯烃
主反应:2CH3OH![]() C2H4+2H2O i;
C2H4+2H2O i;
3CH3OH![]() C3H6+3H2O ii
C3H6+3H2O ii
副反应:2CH3OH![]() CH3OCH3+H2O iii
CH3OCH3+H2O iii
某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行甲醇制烯烃的对比研究,得到如下实验数据(选择性:转化的甲醇中生成乙烯和丙烯的百分比)
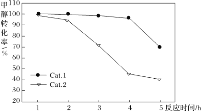
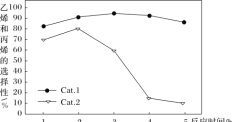
由图像可知,使用Cat.2反应2h后甲醇的转化率与乙烯和丙烯的选择性均明显下降,可能的原因是(结合碰撞理论解释)_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是有机合成中一种有用的中间体。某研究小组以丙烯醛为原料,设计了如下路线合成环丁基甲酸。


请回答:
(1)化合物C的结构简式是 __________________。
(2)下列说法中不正确的是__________________ 。
A.化合物A能与NaHCO3溶液反应
B.化合物B和C能形成高聚物
C.化合物G的化学式为C6H8O4
D.1 mol化合物B与足量金属钠反应能生成1 mol氢气
(3)写出D + E → F的化学方程式:__________________。
(4)环丁基甲酸与苯酚反应生成一种酯X,写出化合物X满足下列条件的所有同分异构体的结构
简式:__________________
① 能使FeCl3溶液变紫色;
② 含有丙烯醛中所有的官能团;
③ 1H-NMR谱显示分子中含有5种不同化学环境的氢原子。
(5) 以1,3-丁二烯和E为原料可制备环戊基甲酸(![]() ),请你选用必要试剂,设计该合成路线。__________________
),请你选用必要试剂,设计该合成路线。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的绿色消毒剂,纯ClO2易分解爆炸,其一种生产工艺如下,回答下列问题:
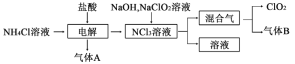
(1)气体A的名称为___________________,NCl3的电子式为_________。
(2)“电解”过程中生成的氧化产物与还原产物的物质的量之比为________。
(3)气体B能使石蕊试液显蓝色,写出NaClO2溶液和NCl3溶液在碱性条件下生成“混合气”的化学方程式____________。
(4)通常用单位质量的消毒剂得到电子的多少来衡量消毒效率的大小。C1O2和C12在消毒时自身均被还原为Cl-,则C1O2的消毒效率是Cl2的__________倍。
(5)科学家又研究出了一种新的制备C1O2的方法,反应原理如下:H2C2O4+2NaClO3+H2SO4=Na2SO4+2CO2↑+2ClO2↑+2H2O。此法提高了生产及储存、运输的安全性,原因是_____________________。若反应中转移1mol电子,则生成C1O2 ______ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸钠
B. 苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化
C. ![]() 在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
D. 苯甲醛、苯乙烯分子中的所有原子可能处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com