
分析 常温下,向25mL0.1mol•L-1的HCl溶液中逐滴加入0.1mol•L-1的NaOH溶液,当加入24.95mL时,酸过量,根据混合溶液中的c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{总}}$来计算,而溶液的pH=-lgc(H+);当加入氢氧化钠溶液25.05mL时,碱过量,溶液显碱性,混合溶液中的c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{总}}$,则溶液中的c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$,然后根据溶液的pH=-lgc(H+)来计算.
解答 解:常温下,向25mL0.1mol•L-1的HCl溶液中逐滴加入0.1mol•L-1的NaOH溶液,当加入24.95mL时,酸过量,溶液显酸性,故先计算溶液中的氢离子浓度,而混合溶液中的c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{总}}$=$\frac{0.1mol/L×0.025L-0.1mol/L×0.02495L}{0.025L+0.02495L}$≈$\frac{5×1{0}^{-6}mol}{0.05L}$=10-4mol/L,则溶液的pH=-lgc(H+)=4;
当加入氢氧化钠溶液25.05mL时,碱过量,溶液显碱性,故先求溶液中氢氧根浓度,溶液中的c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{总}}$=$\frac{0.1mol/L×0.02505L-0.1mol/L×0.025L}{0.02505L+0.025L}$=10-4mol/L,则溶液中的c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{1{0}^{-4}}$=10-10mol/L,故溶液的pH=-lgc(H+)=10.
故答案为:4;10.
点评 本题考查了酸碱混合后溶液pH的有关计算,难度不大,应注意的是混合后显酸性则先求氢离子浓度,混合后显碱性则先求氢氧根浓度.


科目:高中化学 来源: 题型:解答题
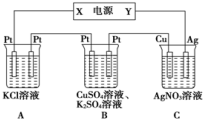 (1)若向Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,试从平衡的角度解释沉淀转化的原因:氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,最有氢氧化镁全部转化为红褐色的氢氧化铁沉淀
(1)若向Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,试从平衡的角度解释沉淀转化的原因:氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,最有氢氧化镁全部转化为红褐色的氢氧化铁沉淀查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
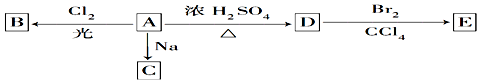
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO2、CO、烟尘 | B. | HCl、SO2、N2、粉尘 | C. | NH3、CO2、NO、雾 | D. | CO2、Cl2、O2、酸雨 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com