
分析 某温度下,向容积为10L的密闭容器中充人1mol A气体和1mol B气体,经2s后达到平衡,测得B的浓度为0.02mol•L-1,则:
A(g)+B(g)?2C(g)
起始浓度(mol/L):0.1 0.1 0
变化浓度(mol/L):0.08 0.08 0.16
平衡浓度(mol/L):0.02 0.02 0.16,
以此计算相关物理量.
解答 解:某温度下,向容积为10L的密闭容器中充人1mol A气体和1mol B气体,经2s后达到平衡,测得B的浓度为0.02mol•L-1,则:
A(g)+B(g)?2C(g)
起始浓度(mol/L):0.1 0.1 0
变化浓度(mol/L):0.08 0.08 0.16
平衡浓度(mol/L):0.02 0.02 0.16,
(1)该温度下反应的平衡常数为$\frac{0.1{6}^{2}}{0.02×0.02}$=64,
答:该温度下反应的平衡常数为64;
(2)达到平衡时A的转化率为$\frac{0.08}{0.1}×100%$=80%.
答;达到平衡时A的转化率为80%.
点评 本题考查化学平衡的计算,为高频考点,侧重于学生的分析能力的考查,注意把握计算的思路、方法,难度不大.


科目:高中化学 来源: 题型:解答题
 ,HCN中C的化合价为-2.
,HCN中C的化合价为-2.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
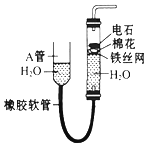 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粉末Zn与2mol•L-1硫酸溶液反应 | B. | 粉末状Mg与2mol•L-1硫酸溶液反应 | ||
| C. | 粉末状Na与2mol•L-1硫酸溶液反应 | D. | 粉末状Al与2mol•L-1硫酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛、乙醛、丙醛都没有同分异构体 | |
| B. | 已知甲醛是平面型分子,则苯甲醛的所有原子有可能在同一平面上 | |
| C. | 甲醛、乙醛、苯甲醛都能发生加成、氧化和酯化反应 | |
| D. | 可用新制的Cu(OH)2来区分甲醛和苯甲醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
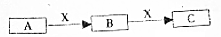 A、B、C是中学化学常见的三种物质.它们之间的相互转化关系如下(部分反条件及反应物产物略去)
A、B、C是中学化学常见的三种物质.它们之间的相互转化关系如下(部分反条件及反应物产物略去)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com