
W、M、N、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻;X的单质是一种常见的半导体材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大。

(1)元素X在周期表中的位置是_______________;元素Y的离子结构示意图为____________
(2)下列有关物质性质的比较中.正确的是________________
A.M、X、Z形成的单质熔沸点 M>X>Z
B.氢化物的热稳定性:W>X
C.X分别与W和Z形成的化合物中化学键类型,晶体类型均相同
D.Z元素含氧酸的酸性一定强于Y元素的含氧酸
(3)元素W与M按原子个数比1:1形成的化合物A的电子式为______________。
(4)X、Z与氢三种元素按1:2:2形成的五原子化合物属于_______分子(填 “极性” “非极性”)
(5)与Z同族的元素都能形成氢化物,其中水溶性最强的是______(填化学式)
(6)含有N元素的两种常见离子能发生双水解反应,试写出该离子方程式 ________________。
(1)第三周期第IVA族(1+1分);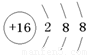 (2分)
(2分)
(2)B(2分)
(3)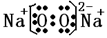 (2分)
(2分)
(4)极性(2分)
(5)HF(2分)
(6)Al3+ + 3AlO2﹣+ 6H2O = 4Al(OH)3↓(2分)
【解析】
试题分析:(1)X单质是一种半导体材料,所以X为硅元素,Y的最外层电子数是最内层电子数的三倍又在硅元素后面,所以Y是硫元素;
(2)推断W为氧,M是钠,N是铝,X是硅,Y是硫,Z是氯,A、M、X、Z形成的单质熔沸点X>M>Z,错误;B、正确;C、硅和氧形成的是共价键,硅和氯形成的是离子键,错误;D、盐酸的酸性没有硫酸的强,错误。
(3)过氧化钠中既有共价键也有离子键;
(4)氯元素以离子键与别的元素结合,含有离子键,所以为极性分子;
(5)卤素氢化物的水溶性HF>HCl>HBr>HI;
(6)铝离子和偏铝酸根离子能发生双水解。
考点:常见的短周期元素。


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z、W、M、N六种短周期元素,其中X、Y、Z、W同周期,Z与M、N与Y分别同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。
元素X与 M形成X2M2型化合物中阴阳离子个数比为:____________
YM2晶体属于_____________晶体(填晶体类型);30g YM2晶体中含_________条共价键(阿伏加德罗常数用NA表示)
在工业上常用电解饱和XW的溶液来制碱。若用阴极室产生的气体为碱性燃料电池的燃料,则燃料电池中该气体所在电极为_______极,电极反应式为:_________________。
已知单质A为常见黑色固体粉末,B是元素Z的最高价含氧酸,其存在如图所示的转换关系:
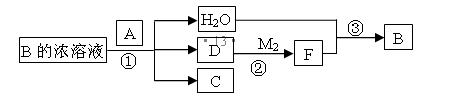
(I) 若向C中滴加KSCN溶液立即呈血红色。则:常温下A在B的浓溶液中难以溶解的原因是 ;因此反应①的的条件是 。在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 ;
(II) 按要求写方程式:
写出反应②的化学方程式 ,
写出C与小苏打溶液反应的离子方程式 ,
(III) 若A是元素N的单质写出反应①的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z、W、M、N六种短周期元素,其中X、Y、Z、W同周期,Z与M、N与Y分别同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1) 元素X与 M形成X2M2型化合物中阴阳离子个数比为:____________
(2) YM2晶体属于_____________晶体(填晶体类型);30g YM2晶体中含_________条共价键(阿伏加德罗常数用NA表示)
(3) 在工业上常用电解饱和XW的溶液来制碱。若用阴极室产生的气体为碱性燃料电池的燃料,则燃料电池中该气体所在电极为_______极,电极反应式为:_________________。
(4) 已知单质A为常见黑色固体粉末,B是元素Z的最高价含氧酸,其存在如图所示的转换关系:
(I) 若向C中滴加KSCN溶液立即呈血红色。则:常温下A在B的浓溶液中难以溶解的原因是 ;因此反应①的的条件是 。在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 ;
(II) 按要求写方程式:
写出反应②的化学方程式 ,
写出C与小苏打溶液反应的离子方程式 ,
(III) 若A是元素N的单质写出反应①的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省鹤岗一中高二下学期期中考试化学试卷(带解析) 题型:填空题
X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族元素氢化物的沸点高,但在同周期中却不是最高的。W是同周期元素中离子半径最小的元素。M原子的最外能层上有两个运动状态不同的电子。N是一种“明星金属”,广泛应用于航天、军事等工业领域。请回答下列问题: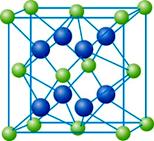
⑴X、Y两种元素的元素符号是: 、 。X、Y可以形成一种共价化合物,其中两种元素最外层电子数都达到8,则其分子的空间构型是: ;中心原子的杂化方式是: 。
⑵X的氢化物易溶于水的其原因是: 。
⑶M与Y形成的化合物的其晶胞如图所示,其中M离子平均个数是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com