
【题目】下列过程中生成物的总能量高于反应物的总能量的是( )
A. HCl + NaOH = NaCl+H2O B. CaO+H2O=Ca(OH)2
C. 2Na + 2H2O = 2NaOH+H2↑ D. H—Br → H + Br
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
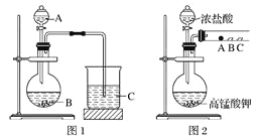
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 L密闭容器中进行反应:pZ(g)+qQ(g) ![]() mX(g)+nY(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
mX(g)+nY(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
物质 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3 min末/mol | 0.8 |
已知:2 min内v(Q)=0.075 mol·L-1·min-1,v(Z)∶v(Y)=1∶2。
请回答下列问题:
(1)2 min内X的反应速率v(X)=__________。
(2)起始时n(Y)=__________。
(3) 3 min末是否达到平衡_______(填是或否)。
(4)对于该反应,能增大正反应速率的措施是________(填序号,下同)。
A.缩小容器体积 B.移走部分Q
C.通入大量He气 D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌剂,实验室可通过下列反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是![]()
![]()
A. KClO3在反应中得到电子B. ClO2是氧化产物
C. H2C2O4被还原D. 1molKClO3发生反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。温度过高,二氧化氯的水溶液有可能爆炸。其制备方法有:
(1)方法一:用氯酸钠(NaClO3)和硫酸酸化的H2O2反应生成ClO2。请写出该反应的化学方程式___________________________________________。
(2)方法二:用氯酸钠氧化浓盐酸,生成二氧化氯的同时会有氯气产生。请写出该反应的化学方程式_____________________________________。
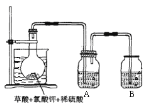
(3)方法三、
①如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),
然后再加入足量的稀硫酸,水浴加热。反应后产物中有
ClO2、CO2和一种酸式盐,该反应的化学方程式为:__________________________________,
氧化产物与还原产物的物质的量之比为____________。
②控制水浴温度在60~80℃之间的目的是_______________________,
图示装置中缺少的一种必须的玻璃仪器是____________。
③A装置用于吸收产生的二氧化氯,其中最好盛放________。(填序号)①60 ℃的温水 ②冰水 ③饱和食盐水
④将足量二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫有多种化合物,如H2S、COS(羰基硫)、SO2等,它们对环境均有一定的影响。
(1)H2S经 K2CO3溶液吸收后,生成两种酸式盐。其中无氧酸的酸式盐的化学式是________________。
(2)COS(羰基硫)燃烧时有SO2生成,其原理为:2COS+3O2![]() 2CO2+2SO2。若转移3.612×1025个电子,则参加反应COS(羰基硫)的物质的量是_________________mol。
2CO2+2SO2。若转移3.612×1025个电子,则参加反应COS(羰基硫)的物质的量是_________________mol。
(3)电厂排出的烟气中含有CO、SO2等。它们在一定条件下可转化为一种固体和一种无害气体。该反应的化学方程式是______________________________。其中氧化剂与还原剂物质的量之比为______________。
(4)石灰石作为脱硫剂,可有效吸收废气中的SO2,减少酸雨的产生。
①在煤炭中加入石灰石可减少燃烧时SO2的排放量,并生成CaSO4。该反应的化学方程式是____________。
②你认为减少酸雨产生的途径可采取的措施是____________________(填序号)。
a.避免直接用高硫煤作燃料 b.把工厂的烟囱造高
c.燃料脱硫 d.开发新能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写下列空白
如下图所示,a、b均为活塞,可控制气体的通过和液体的加入,实验前活塞均已关闭(仪器的固定装置已省略)。请选择最适宜的试剂,利用下图,把一定量的CO2和CO混合气体中的CO2和CO分离。可供选择的试剂有:浓硫酸、稀硫酸、浓盐酸、稀盐酸、氢氧化钠溶液、紫色石蕊试液。

(1)甲装置的烧瓶中盛放的试剂是_____________,分液漏斗中盛放的试剂是__________;
(2)乙装置的瓶中盛放的试剂是_______________。
(3)打开活塞a时,分离出来的气体是________;要得到另一种气体时,正确的操作是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3O4可表示成FeO·Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-![]() +O2+4OH-
+O2+4OH-![]() Fe3O4+S4O62-
Fe3O4+S4O62-![]() +2H2O。下列说法正确的是( )
+2H2O。下列说法正确的是( )
A. O2和S2O32-是氧化剂,Fe2+是还原剂
B. 若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol
C. 每生成1 mol Fe3O4 ,转移电子的物质的量为2 mol
D. 参加反应的氧化剂与还原剂的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图两套基础实验装置回答问题。
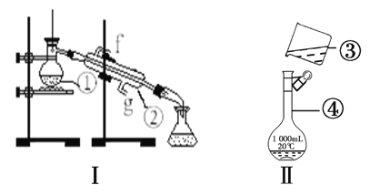
(1)写出下列仪器的名称:______________、___________________。
(2)仪器①~④中,使用时必须检查是否漏水的有____________________。(填序号)
(3)用装置I制蒸馏水,还缺少的仪器有_________,冷却水从_______口进。
(4)a.现需配制250mL0.2molL-1NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是_______________,_______________。
b.配制过程中,下列情况会使配制结果偏高的是________________(填序号)。
①定容时俯视刻度线观察液面;②容量瓶使用时未干燥;③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线;④移液时未洗涤烧杯和玻璃棒
c.若实验中加蒸馏水时不慎超过了刻度,应如何处理?______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com