
| A. | 盛装浓硫酸的烧杯敞口放置一段时间后质量增加 | |
| B. | 把铜片放入浓硫酸中并加热有气体产生 | |
| C. | 常温下可用铁、铝容器盛装浓硫酸 | |
| D. | 向蔗糖中加入浓硫酸,蔗糖变黑膨胀并有刺激性气味的气体放出 |
分析 浓硫酸具有脱水性,可将有机物中的氢氧原子以2:1脱去,表现为强氧化性,在反应中S元素化合价降低,被还原生成二氧化硫,以此解答该题.
解答 解:A.盛装浓硫酸的烧杯敞口放置一段时间后质量增加,与浓硫酸的吸水性有关,故A不选;
B.把铜片放入浓硫酸中并加热有气体产生,反应生成二氧化硫,浓硫酸表现强氧化性,没有表现脱水性,故B不选;
C.浓硫酸具有强氧化性,在常温下可与铁、铝发生钝化反应,故C不选;
D.向蔗糖中加入浓硫酸,蔗糖变黑,说明蔗糖被碳化,膨胀并有刺激性气味的气体放出,说明发生氧化还原反应生成气体,气体为二氧化碳、二氧化硫,故D选.
故选D.
点评 本题以浓硫酸为载体考查了吸水性、脱水性、氧化性及实验室安全等知识点,根据浓硫酸的性质来分析解答,注意吸水性和脱水性的区别,题目难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冒白雾,混合物温度升高 | B. | 产生黄绿色气体 | ||
| C. | 冒白雾,混合物温度降低 | D. | 液体四溅,冒白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素是典型的非金属元素,不能与其他非金属元素化合 | |
| B. | 卤素单质越活泼,其溶沸点就越低 | |
| C. | 卤素各单质都能和水剧烈反应 | |
| D. | 卤素气态氢化物的稳定性越强,还原性也越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )| A. | 属于芳香烃 | B. | 属于卤代烃 | C. | 属于芳香化合物 | D. | 属于酚类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 以NaBH4(B元素的化合价为+3价)和H2O2作原料的新型燃料电池,可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
以NaBH4(B元素的化合价为+3价)和H2O2作原料的新型燃料电池,可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O | |
| B. | 放电过程中,b电极附近溶液的pH减小 | |
| C. | 电池工作时,Na+从b极区移向a极区 | |
| D. | 若用该电池电解饱和食盐水,转移2 mole-时,阴极析出46gNa |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
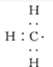 ;
;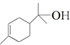 )的官能团的名称为碳碳双键、羟基;
)的官能团的名称为碳碳双键、羟基; 与溴发生加成反应的产物最多有4种,它们的结构简式为
与溴发生加成反应的产物最多有4种,它们的结构简式为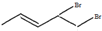 、
、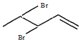 、
、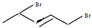 和
和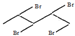 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{z}^{y}$R | B. | ${\;}_{z}^{y+z}$R | C. | ${\;}_{z+x}^{y+z}$R | D. | ${\;}_{z+x}^{y+z+x}$R |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com