

���� Aװ�ò��������������Ȼ�����Һ�����������������е��Ȼ������壬������������ˮ�е��ܽ�ȣ�C���Ʊ�Ư�ۣ�D����֤�������������ԣ���������������β������1������أ�K2MnO4������ǿ�����ԣ���Ũ���ᷴӦ�۲쵽��ƿ�����Ϻ�ɫ�������ɣ�������Ϊ������أ���Ԫ�صĻ��ϼ������ߣ�����K2MnO4�еĻ��ϼ�Ϊ+6�ۣ������м��̬���Ʋ���ڷ�Ӧ�м���������������ԭ�����ٽ����ƿ���к�ɫ������࣬���뵽��������д����һ������ʽ���ڶ�����Ӧ�Ǹ��������Ũ���ᷴӦ�����������Ȼ��̡��Ȼ��ء�ˮ��
��2�����������Ũ������ø����������Ũ���ᷴӦ��������
��3������ʯ�����������Ʊ�Ư�ۣ�
���մɶ�����ݵ���������������Ӵ������ʹ�������ո���֣�
��4���ٷ�Ӧ�����еⵥ�����ɣ��õ�����ָʾ�������һ�α�Һ����ʱ����Һ��Ϊdz��ɫ������Ӳ���ɫ����ﵽ�յ㣻
���ȸ��ݷ�Ӧ���ӷ���ʽȷ����ClO-��I-�Ĺ�ϵ�����������Ƶ��������ٸ�������������ʽ���㣻
��5����Һ©�����������ɼ�1���������������Ⱶ���������ᱵ������ȡD�з�Ӧ����Һ���μ������ữ�������������а�ɫ��������������֤�������������������Ⱶ����Ϊ������ˮ��ӦҲ���������ӣ�����֤����Һ�е�������һ�������������������Ⱶ���ò��
��� �⣺Aװ�ò��������������Ȼ�����Һ�����������������е��Ȼ������壬������������ˮ�е��ܽ�ȣ�C���Ʊ�Ư�ۣ�D����֤�������������ԣ���������������β����
��1������أ�K2MnO4������ǿ�����ԣ���Ũ���ᷴӦ�۲쵽��ƿ�����Ϻ�ɫ�������ɣ�������Ϊ������أ���Ԫ�صĻ��ϼ������ߣ�����K2MnO4�еĻ��ϼ�Ϊ+6�ۣ������м��̬���Ʋ���ڷ�Ӧ�м���������������ԭ�����ٽ����ƿ���к�ɫ������࣬���뵽��������д����Ӧ����ʽΪ��3K2MnO4+4HCl��Ũ���ᣩ=2KMnO4+4KCl+MnO2+2H2O���ڶ�����Ӧ�Ǹ��������Ũ���ᷴӦ�����������Ȼ��̡��Ȼ��ء�ˮ������ʽΪ��2KMnO4+16HCl��Ũ���T2KCl+2MnCl2+5Cl2��+8H2O��
�ʴ�Ϊ��3K2MnO4+4HCl��Ũ���ᣩ=2KMnO4+4KCl+MnO2+2H2O��2KMnO4+16HCl��Ũ���T2KCl+2MnCl2+5Cl2��+8H2O��
��2����������ɸ����������������������ʣ��γɾ��ȵĹ����ɢϵ���ɽ�������������ᷴӦ���ʣ��������������ȡ�������ô����ĸ������Ҫ����ƽ�����࣬
�ʴ�Ϊ����������ɸ����������������������ʣ��γɾ��ȵĹ����ɢϵ���ɽ�������������ᷴӦ���ʣ�
��3������ʯ�����������Ʊ�Ư�ۣ�
�ʴ�Ϊ��ʯ���飻
���մɶ�����ݵ���������������Ӵ������ʹ�������ո���֣�
�ʴ�Ϊ����������Ӵ������ʹ�������ո���֣�
��4���ٷ�Ӧ�����еⵥ�����ɣ��õ�����ָʾ�������һ�α�Һ����ʱ����Һ��Ϊdz��ɫ������Ӳ���ɫ����ﵽ�յ㣬
�ʴ�Ϊ�����ۣ����һ�α�Һ����ʱ����Һ��Ϊdz��ɫ������Ӳ���ɫ��
���ȸ��ݷ�Ӧ���ӷ���ʽȷ����ClO-��I-�Ĺ�ϵ��
3ClO-+I-=3Cl-+IO3-�٣�IO3-+5I-+3H2O=6OH-+3I2��
������ʽ��+�ڵã�ClO-+2I-+H2O=Cl-+2OH-+I2
ÿ��ʵ������KI��Һ�����Ϊ20.00mL�������������ӵ����ʵ���Ϊx��
ClO-+2I-+H2O=Cl-+2OH-+I2
1mol 2mol
x 0.1000mol•L-1��0.020L
����x=0.001mol
ÿ��ʵ�������Ƶ�����Ϊ��143g/mol��0.001mol��0.5=0.0715g������ʵ��������Ϊ0.0715g��3=0.2145g��
��������������$\frac{0.2145g}{1.5g}$��100%=14.3%��
�ʴ�Ϊ��14.3%��
��5����Һ©�����������ɼ�1���������������Ⱶ���������ᱵ������ȡD�з�Ӧ����Һ���μ������ữ�������������а�ɫ��������������֤�������������������Ⱶ����Ϊ������ˮ��ӦҲ���������ӣ�����֤����Һ�е�������һ�������������������Ⱶ���ò��
�ʴ�Ϊ�����ְ�ɫ����������ȷ��������ˮ��ӦҲ���������ӣ�����֤����Һ�е�������һ�������������������Ⱶ���ò��
���� ���⿼�������������ʼ�ʵ�����ƣ��ѶȽϴ��״���ڣ�1���ⷽ��ʽ����д���������Ϣ��������ԭ��Ӧ�Ĺ��ɽ����ƶϣ��״���ڣ�4���⣬ע��ClO-Ϊ0.001molʱ��Ca��ClO��2�����ʵ���Ϊ0.001mol��0.5������ƽ��ʵ��Ư�۵�������1.5g������û����ȷ��1.5g����Ư�������Һ��ֳ����ȷݣ�ע�����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Ԫ������ԭ�Ӱ뾶��С | |
| B�� | Al3+��Na+��O2-���뾶�������� | |
| C�� | P��S��Cl��������������� | |
| D�� | ﮡ��ơ��ء�﨡�蘆��ʵ��۵������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ú��Һ�� | B�� | ʯ�ͷ��� | C�� | ú�ĸ��� | D�� | ���ʹ��ѻ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C25H50COOH | B�� | C26H47COOH | C�� | C26H41COOH | D�� | C25H39COOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
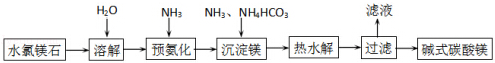
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʢװŨ������ձ����ڷ���һ��ʱ����������� | |
| B�� | ��ͭƬ����Ũ�����в�������������� | |
| C�� | �����¿�������������ʢװŨ���� | |
| D�� | �������м���Ũ���ᣬ���DZ�����Ͳ��д̼�����ζ������ų� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com