
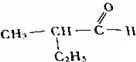 的是( )
的是( )| A. | 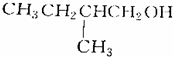 | B. | 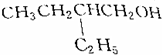 | ||
| C. |  | D. | 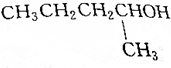 |
科目:高中化学 来源: 题型:选择题
| A. | v(甲)>v(乙)>v(丙) | B. | v(乙)>v(丙)>v(甲) | C. | v(丙)>v(乙)>v(甲) | D. | v(乙)>v(甲)>v(丙) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融状态下硫酸氢钾的电离方程式:KHSO4═K++H++SO42- | |
| B. | Cl-的结构示意图: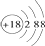 | |
| C. | 中子数为8的碳原子:${\;}_{6}^{14}$C | |
| D. | NaCl的电子式: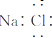 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
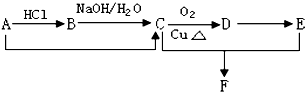
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳和环氧丙烷在催化作用下可生成一种可降解的高聚物,可减少二氧化碳对环境的影响 | |
| B. | 化石燃料的燃烧和含硫金属矿石的冶炼等都是造成SO2污染的重要原因 | |
| C. | 氟氯烃的大量使用会破坏臭氧层,火箭、导弹将大量废气排放到高空,也会加速臭氧分解 | |
| D. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH}{→}$Na2SiO3(aq) | |
| B. | CuO$→_{△}^{H_{2}}$Cu$\stackrel{稀硫酸}{→}$CuSO4(aq) | |
| C. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO4 | |
| D. | NaCl饱和溶液$→_{②CO_{2}}^{①NH_{3}}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
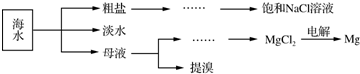
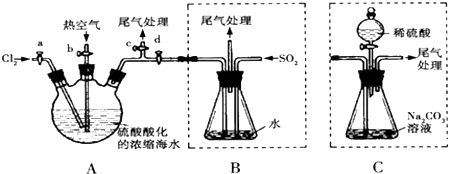
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com