
| A. | v(甲)>v(乙)>v(丙) | B. | v(乙)>v(丙)>v(甲) | C. | v(丙)>v(乙)>v(甲) | D. | v(乙)>v(甲)>v(丙) |
分析 同一化学反应中,同一时间段内,各物质的反应速率之比等于其化学计量数之比;先把不同物质的反应速率换算成同一物质的反应速率进行比较,从而确定选项.
解答 解:合成氨反应为N2(g)+3H2(g)?2NH3(g),以氢气的反应速率为标准进行判断.
甲:v(H2)=3mol•L-1•min-1;
乙:v(N2)=2mol•L-1•min-1,反应速率之比等于其化学计量数之比,所以v(H2)=3v(N2)=6mol•L-1•min-1;
丙:v(NH3)=1mol•L-1•min-1,反应速率之比等于其化学计量数之比,所以v(H2)=1.5v(N2)=1.5mol•L-1•min-1;
所以反应速率v(乙)>v(甲)>v(丙).
故选D.
点评 本题考查了化学反应速率快慢的比较,难度不大,注意要把不同物质的反应速率换算成同一物质的反应速率进行比较,还要注意单位是否相同.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
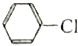 的水解反应均有醇生成.
的水解反应均有醇生成.| A. | 全都正确 | B. | 除⑤ | C. | 除⑥ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.1g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1mol丙烯醛中含有双键的数目为0.1NA | |
| C. | 标准状况下,2.24L乙醇中含有的分子数目为0.1NA | |
| D. | 1molNaHSO4固体中阳离子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
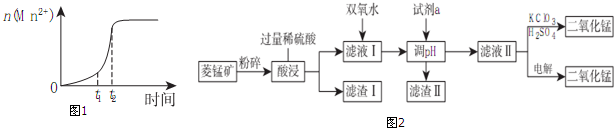
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时pH | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时pH | 10.0 | 8.4 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2-、Cl-、K+ | B. | Cl-、Na+、Al3+ | C. | Na+、Mg2+、F- | D. | O2-、Mg2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | B. | 物质的量 C:CuO:Fe=3:2:2 | ||
| C. | 质量 MnO2:CuO:C=5.5:8:12 | D. | 质量 Fe:C:CuO=7:5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制铝:以铝土矿为原料获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 | |
| B. | 制镁:用海水为原料,经一系列过程制得氧化镁固体,电解熔融氧化镁得镁 | |
| C. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| D. | 制铁:以铁矿石为原料,利用焦炭与氧气反应生成的CO在高温下还原得铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com