
| A.V1>V2>V3 | B.V1<V2<V3 |
| C.V1=V2>V3 | D.V1=V2<V3 |
科目:高中化学 来源:不详 题型:填空题
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2-甲基丁烷 | 3 531.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
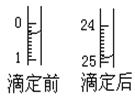
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0—8.0 | 3.1—4.4 | 4.4—6.2 | 8.2—10.0 |
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.80 | 25.30 |
| 2 | V | | | |
| 3 | V | 6.00 | 31.35 | 25.35 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶9 | B.1∶1 | C.1∶2 | D.1∶4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 与上述混合溶液中
与上述混合溶液中 相等
相等查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢气的燃烧热为285.5 kJ·mol·-1,则水分解的热化学方程式为:2H2O(l)=2H2+O2(g)ΔH=+285.5 kJ·mol-1 |
| B.已知2C(石墨,s)+O2(g)=2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1 |
C.已知N2(g)+3H2(g)  2NH3(g)ΔH=-92.4 kJ·mol-1, 2NH3(g)ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量 |
| D.已知乙醇和乙烯的燃烧热分别为1 366.8 kJ·mol-1和1 411.0 kJ·mol-1,则乙烯水化制乙醇的热化学方程式为:C2H4(g)+H2O(l)=C2H5OH(l) ΔH=-44.2 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图中对应点的温度关系为A>B |
| B.水的电离常数KW数值大小关系为B>D |
| C.温度不变,加入少量NaOH可使溶液从C点变到A点 |
| D.在B点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com