
下列有关铁及其化合物的说法中正确的是
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质,可以向溶液中加入过量铁粉,然后过滤
D.Fe3+与KSCN产生红色沉淀
科目:高中化学 来源: 题型:
某晶体水溶液中加入Fe2+的溶液,再加稀硝酸溶液立即变红,另取 该晶体,加入NaOH溶液共热产生一种能使湿润红色石蕊试纸变蓝的气体,则这种晶体是
该晶体,加入NaOH溶液共热产生一种能使湿润红色石蕊试纸变蓝的气体,则这种晶体是
A.KSCN B.NH4SCN
C.NH4Cl D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
把下列四种X溶液,分别加入四个盛有10mL2mol·L-1盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸能缓慢地进行反应。其中反应速率最大的是( )
A、20mL3mol·L-1的X溶液
B、20mL2mol·L-1的X溶液
C、10mL4mol·L-1的X溶液
D、10mL2mol·L-1的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于钠的化合物的说法中,正确的是
A.Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应
B.Na2CO3固体中含有的NaHCO3可用加热的方法除去
C.Na2O2和Na2O均为白色固体,与CO2反应均放出O2
D.分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,现象相同
查看答案和解析>>
科目:高中化学 来源: 题型:
托盘天平的两盘中各放一只盛有等体积、等物质的量浓度盐酸的小烧杯,调整天平平衡后向两烧杯中分别加入等质量的Fe粉和Zn粉,下列现象不可能出现的是
A.开始天平加锌的一端上升 B.最终天平加锌的一端上升
C.最终天平仍平衡 D.最终加铁的一端上升
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属的说法中,正确的是
①纯铁不容易生锈 ②钠着火用水扑灭
③铝在空气中耐腐蚀,所以铝是不活泼金属 ④缺钙会引起骨质疏松,缺铁会引起贫血
⑤青铜、不锈钢、硬铝都是合金 ⑥KSCN溶液可以检验Fe3+
A.①④⑤⑥ B.②③④⑤ C.①③④⑤ D.①②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列各题。
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为: 。
(2)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式: 。
(3)MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的化学方程式为: 。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 。
(4)(CN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | NH4Cl为强酸弱碱盐 | 加热可除去NaCl中的NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一] 测定硫元素的含量
Ⅰ.将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处持续不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
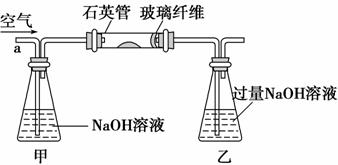
Ⅱ.反应结束后,将乙瓶中的溶液按下述流程进行处理。
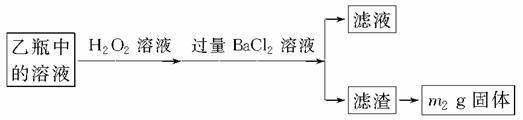

[实验二] 测定铁元素的含量
Ⅲ.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释 至250 mL;
至250 mL;
④每次取稀释液25.00 mL,用物质的量浓度为c mol·L-1的酸性KMnO4溶液滴定。三次滴定实验所需KMnO4溶液体积的平均值为V mL(该反应中还原产物为Mn2+)。
请完成下列问题:
(1)已知12 g FeS2完全燃烧放热85.3 kJ,则表示FeS2燃烧热的热化学方程式是_______________________________________________________________________。
(2)Ⅰ中乙瓶内发生反应的离子方程式有_______________________________________________________________________。
Ⅰ中玻璃纤维的作用是_______________________________________________。
(3)Ⅱ中的滤渣在称量前还应进行的操作是_______________________________。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还有________________。
(5) 该黄铁矿中铁元素的质量分数________________(用Ⅰ、Ⅲ中有关实验数据表达)。
该黄铁矿中铁元素的质量分数________________(用Ⅰ、Ⅲ中有关实验数据表达)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com