
A、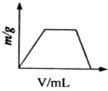 |
B、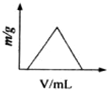 |
C、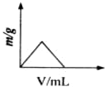 |
D、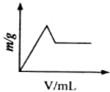 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、一定是加入金属镁的一端下倾 |
| B、一定是加入金属铝的一端下倾 |
| C、一定是仍然保持平衡 |
| D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间 | 开始 | 8h后 | 16h 后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、回收照相业中的定影液可提取镁 |
| B、回收不锈钢可提取铬或镍以及铁 |
| C、回收可口可乐易拉罐可回收铝 |
| D、回收精炼铜的阳极泥可得金、银等贵金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
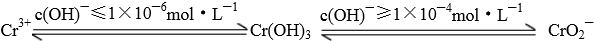

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
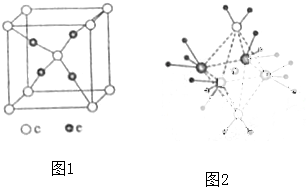
查看答案和解析>>
科目:高中化学 来源: 题型:
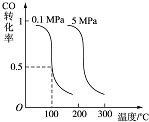 CO可用于合成甲醇.在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g)平衡时CO的转化率与温度、压强的关系如图:
CO可用于合成甲醇.在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g)平衡时CO的转化率与温度、压强的关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述测定不能达到实验目的 |
| B、剩余的7.48g金属为铜 |
| C、共生成NO气体0.04mol |
| D、该合金中铜的质量分数为69.2% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com