
| A、0.46g |
| B、0.02g |
| C、0.80g |
| D、0.23g |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和聚乙烯都能发生加成反应 |
| B、淀粉和纤维素的分子式相同,互为同分异构体 |
| C、粮食酿酒的过程涉及到了水解反应、氧化还原反应等复杂变化 |
| D、向蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4 溶液,蛋白质均发生变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
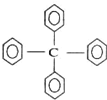
| A、该物质的分子式为C25H20 |
| B、该物质所有氢原子不可能在同一平面上 |
| C、该物质属于烷烃 |
| D、该物质的一氯代物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
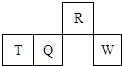 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A、原子半径一定是:T>Q>R |
| B、最高价氧化物对应水化物的酸性一定是:Q<W |
| C、含T的盐溶液一定显酸性 |
| D、最简单气态氢化物的热稳定性一定是:R>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③⑥ | C、②④ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
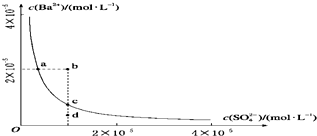
| A、加入Na2SO4可以使溶液由a点变到c点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、b、d点都是不能长时间稳定存在的点 |
| D、a点对应的Ksp大于c点对应的Ksp |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com