
【题目】已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是
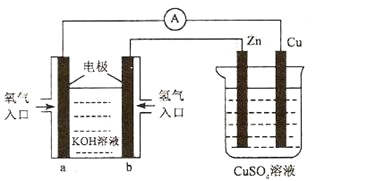
A. 该装置中Cu极为正极
B. 当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L
C. b极反应的电极反应式为:H2-2e-=2H+
D. 一段时间后锌片质量减少
【答案】B
【解析】
试题已知外电路中,电子由铜流向a极,根据装置图分析,左边为氢氧燃料电池,a为正极,电极反应为:O2+2H2O+4e-=4OH-,b为负极电极反应为H2+2OH--2e-=2H2O,右边装置为电解池,Zn做阴极,电极反应为Cu2++e-=Cu;Cu做阳极,电极反应为Cu-2e-=Cu2+;A、分析判断,铜为电解池中的阳极,A错误;B、当铜极的质量变化为12.8g时物质的量为0.2ml,依据电子守恒和电极反应可知,O2+2H2O+4e-=4OH-,Cu-2e-=Cu2+;2Cu~O2,a极上消耗的O2在物质的量为0.1mol在标准状况下的体积为2.24L,B正确;C、锌做电解池的阴极,质量不变,C错误;D、b电极是氢气失电子发生氧化反应,在碱性溶液中生成水,电极反应为:H2+2OH--2e-=2H2O,D错误;所以选B.


科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+3H2(g) ![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. N2、H2和NH3的质量分数不再改变
B. c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C. 断裂1 mol N≡N键的同时,形成6 mol N—H键
D. N2与H2的物质的量之和是NH3的物质的量的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<O,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) △H<O,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是

A. 图I研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图II研究的是t0时刻增大压强后对反应速率的影响
C. 图III研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影晌.且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
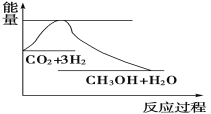
A. ΔH>0,ΔS>0 B. ΔH>0,ΔS<0 C. ΔH<0,ΔS>0 D. ΔH<0,ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,对于反应N2(g)+3H2(g)![]() 2NH3 (g)△H=-92.4kJ/mol。N2的平衡转化率α(N2)与体系总压强(P)的关系如下图所示。下列说法正确的是:
2NH3 (g)△H=-92.4kJ/mol。N2的平衡转化率α(N2)与体系总压强(P)的关系如下图所示。下列说法正确的是:

A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
B. 上述反应在达到平衡后,增大压强,H2 的转化率提高
C. 平衡状态由A变到B时,平衡常数K(A) < K(B)
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1 mol A、2 mol B,此时甲、乙的容积均为2 L(连通管体积忽略不计)。在T℃时,两容器中均发生下述反应:A(g)+2B(g)![]() 2C(g)+3D(g) △H < 0。达平衡时,乙的体积为2.6 L,下列说法正确的是
2C(g)+3D(g) △H < 0。达平衡时,乙的体积为2.6 L,下列说法正确的是
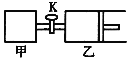
A. 甲中反应的平衡常数小于乙
B. 若打开活塞K,达平衡时乙容器的体积为3.2 L
C. 当乙中A与B的体积分数之比为1:2时,反应达到平衡状态
D. 平衡时甲容器中A的物质的量小于0.55 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)已知甲烷和汽油(可用 C8H18表示)的燃烧的热化学方程式:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ/mol;
C8H18(l)+![]() O2(g)═8CO2(g)+9H2O(l)△H=﹣5472kJ/mol;
O2(g)═8CO2(g)+9H2O(l)△H=﹣5472kJ/mol;
则等质量的甲烷和汽油燃烧,产生的热量比较多的是___________(填“甲烷”或“汽油”)
(2)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成 SiO2和液态 H2O。已知室温下 2gSiH4自燃放出热量 89.2kJ.SiH4自燃的热化学方程式为____________________.
(3)1molH2(g)和1mol Cl2(g)在一定条件下反应生成2 mol HCl(g),放出184.5kJ的热量,已知断裂1molH2(g)中的H-H和1mol Cl2(g)中的Cl-Cl分别需要吸收436.4kJ和242.7kJ的能量,则1mol HCl分子中的化学键形成时释放_________kJ的能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com