
【题目】实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
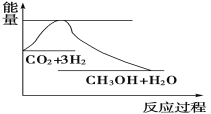
A. ΔH>0,ΔS>0 B. ΔH>0,ΔS<0 C. ΔH<0,ΔS>0 D. ΔH<0,ΔS<0
科目:高中化学 来源: 题型:
【题目】已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H)。下列推测肯定不正确的是
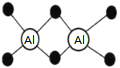
A. 该物质与水反应,属于氧化还原反应
B. Al2H6分子中氢为+1价,铝为﹣3价
C. Al2H6在空气中完全燃烧,产物为氧化铝和水
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列反应中,在理论上可设计成原电池的化学反应是________(填序号),理由是_____________________________________________________。
A.C(s)+H2O(g)===CO(g)+H2(g) ΔH>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(aq)+2NH3·H2O(l)+8H2O(l) ΔH>0
C.CaC2(s)+2H2O(l)===Ca(OH)2(s)+C2H2(g) ΔH<0
D.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH<0
(2)电解原理在化学工业中有着广泛的应用,现将你设计的原电池通过导线与右图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
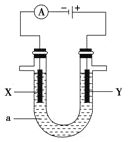
①若X和Y均为惰性电极,a为饱和的NaCl溶液,则电解时,
检验Y电极反应产物的方法是__________________________________________。
②若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程Y电极的电极反应式是___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行下列实验,相关说法正确的是
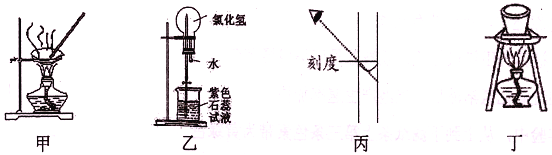
A. 图甲:蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 图乙:形成美丽的红色喷泉,证明HC1极易溶于水
C. 图丙:配制一定物质的量浓度的NaOH溶液,定容时如图则所配NaOH溶液浓度偏低
D. 图丁:所示装置用于除去碳酸氢钠固体中的少量碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是
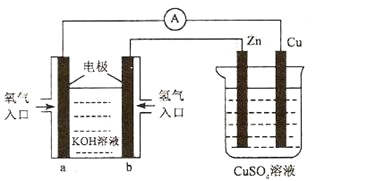
A. 该装置中Cu极为正极
B. 当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L
C. b极反应的电极反应式为:H2-2e-=2H+
D. 一段时间后锌片质量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种气体,取X和Y按物质的量之比1∶1混合,放入某密闭容器中发生反应X+2Y![]() 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
A. 33% B. 40% C. 50% D. 65%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁条,再滴入5 mL的稀盐酸。
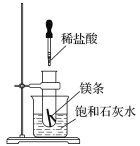
回答下列问题:
(1)实验中观察到的现象是____________________________________________。
(2)产生上述现象的原因是_________________________________________________。
(3)写出有关反应的离子方程式_________________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式回答
(5)②和③按原子数1:2形成的化合物的电子式为____________,该晶体气化的过程中克
服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com