
����Ŀ������A��B��C��D��E���ֶ�����Ԫ�أ���֪A��B��C��D����Ԫ�صĺ���������֮��Ϊ56����Ԫ�����ڱ��е�λ����ͼ��ʾ��1 mol E�ĵ��ʿ��������ᷴӦ���ܲ���33.6L H2(�ڱ�״����)��E����������A�������Ӻ�����Ӳ�ṹ��ͬ��
A | ||
B | C | D |
�ش��������⣺
��1��д��Ԫ��A����______��Ԫ��B����________��Eԭ�ӵ���ʽ________
��2��C�ļ����ӽṹʾ��ͼΪ_____________
��3��B������A������ȼ�գ���Ӧ������___________��������Ļ�ѧʽΪ___________
��4��A��E�γɵĻ�����ĵ���ʽΪ__________���������ʾ������������ʵķ�����Ӧ����____________������������/����������/���������
��5����D��E�γɵĻ������ˮ��Һ�е����ռ���Һ���������˹����й۲쵽��������_________��д��������DE������ռӦ�Ļ�ѧ��Ӧ����ʽ________��
���𰸡��� P ![]()
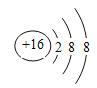 ����ȼ�գ��д������� P2O5
����ȼ�գ��д������� P2O5 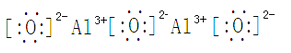 ���������� �ȳ��ְ�ɫ�����������μӣ���ɫ�����ܽ� AlCl3 + 4NaOH == 3NaCl + NaAlO2 + 2H2O
���������� �ȳ��ְ�ɫ�����������μӣ���ɫ�����ܽ� AlCl3 + 4NaOH == 3NaCl + NaAlO2 + 2H2O
��������
��λ��ͼ��֪��A�ڵڶ����ڣ�B��C��D���ڵ������ڣ���C��������Ϊx����A��������Ϊx-8��B��������Ϊx-1��D��������Ϊx+1��A��B��C��D����Ԫ��ԭ�Ӻ����56�����ӣ���x+��x-8��+��x-1��+��x+1��=56�����x=16����AΪO��BΪP��CΪS��DΪCl��1molE���������������ã��ڱ�״�����ܲ�����״����33.6LH2����E�Ļ��ϼ�Ϊy�����ݵ���ת���غ��֪ ymol=![]() ��2=3mol��E����������A�������Ӻ�����Ӳ�ṹ��ȫ��ͬ����EΪAl��Ȼ������Ԫ�ؼ��䵥�ʡ�����������������
��2=3mol��E����������A�������Ӻ�����Ӳ�ṹ��ȫ��ͬ����EΪAl��Ȼ������Ԫ�ؼ��䵥�ʡ�����������������
��1�������֪��Ԫ��A����Ϊ����Ԫ��B����ΪP��Eԭ�ӵ�����㺬��3�����ӣ�����ʽ![]() ��
��
��2��CΪ�����ӽṹʾ��ͼΪ ��
��
��3��B������A������ȼ�գ����������������ף���Ӧ�����Ǿ���ȼ�գ��д������̣�������Ļ�ѧʽΪP2O5��
��4��A��E�γɵĻ�����Ϊ������������ʽΪ![]() �����������ᷴӦ��������Ӧ�����ʾ������������ʵķ�����Ӧ�������������
�����������ᷴӦ��������Ӧ�����ʾ������������ʵķ�����Ӧ�������������
��5����D��E�γɵĻ������Ȼ�����ˮ��Һ�е����ռ���Һ������������ƫ�����ƣ��˹����й۲쵽���������ȳ��ְ�ɫ�����������μӣ���ɫ�����ܽ⣬������ռӦ�Ļ�ѧ��Ӧ����ʽAlCl3 + 4NaOH = 3NaCl + NaAlO2 + 2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ֱ�����ͼ��ʾװ�ö�ԭ��غ͵��ԭ������ʵ��̽����

��ش�
I����ͼ1��ʾװ�ý��е�һ��ʵ�顣
��1���ڱ�֤�缫��Ӧ���������£��������Cu���缫����_________������ĸ��ţ���
A���� | B��ʯī | C���� | D���� |
��2��N��������Ӧ�ĵ缫��ӦʽΪ____________________��
��3��ʵ������У�SO42-_________�����������������������������������������ƶ���
��ֽ���ܹ۲쵽��������___________________��
II����ͼ2��ʾװ�ý��еڶ���ʵ�顣ʵ������У������������������Y������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ��Ȼ���塣�������Ϸ��֣����������FeO42-������Һ�г��Ϻ�ɫ��
��4���������У�X������Һ��pH___________������������ ������С�����������������������У�Y�������ĵ缫��ӦΪFe-6e-+8OH-=FeO42-+4H2O ��_______________��
��5������X���ռ���672 mL���壬��Y���ռ���168 mL���壨��������Ϊ��״��ʱ�������������Y�缫�����缫����������________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NO2��NO��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣���÷�Ӧ6NO2��g��+8NH3��g��![]() 7N2��g��+12H2O��g���ɴ���NO2��
7N2��g��+12H2O��g���ɴ���NO2��
��1����2L���ܱ������У�2�����ڣ�������Ӧ���������ʵ���������0.25mol����2������v��NH3��=______��
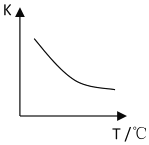
��2���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=______����֪�÷�Ӧƽ�ⳣ����K�����¶ȣ�T���Ĺ�ϵ��ͼ��ʾ���������¶ȣ���v����Ӧ______v�淴Ӧ������ڡ�����С�ڡ����ڡ�������Ӧ�ﵽƽ�������С��Ӧ��������������������䣬���������ƽ��ʽ����______����������С�����䡱����
�����Ǵ�����Ⱦ��Σ��֮һ����������SO2���ĺ����ǿ�����������һ����Ҫָ�ꡣij��ȤС��ͬѧ�ռ�ij�ص���ˮ����ʵ�飬ÿ��1h��ͨ��pH�Ʋⶨ��ˮ��Ʒ��pH����õĽ�����±���
�ⶨʱ��/h | 0 | 1 | 2 | 3 | 4 |
��ˮ��Ʒ��pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
��3����д������pH�仯��ԭ��______��
��4�������ʵ���Ũ����ȵ����������Һ����NH4Cl ��NH4HCO3 ��NH4HSO4����������Һ��ˮ�ĵ���̶��ɴ�С��˳����______�����ţ���
��5����BaCl2��Һ��ͨ������SO2���壬û�г������ɣ������μ�һ�����İ�ˮ������BaSO3�������õ���ƽ��ԭ��������������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ǿ������ʴ�ԣ�����Ǧ����Ϊ���Դ����أ�����Al��������Pb�����������ϡ���ᣨ�ҳأ���ʹ�����������Ĥ����Ӧԭ�����£�
��أ�Pb(s)��PbO2(s)��2H2SO4(aq)��2PbSO4(s)��2H2O(l)��
���أ�2Al��3H2O��![]() ��Al2O3��3H2����
��Al2O3��3H2����
�ر�K���������У������ж���ȷ����

A. ������H��������Pb�缫
B. ���ÿ����3 mol Pb���ҳ�����2 mol Al2O3
C. ���Pb�缫�������ӣ��ҳ�Pb�缫��������
D. ���������Ӧ��PbO2��4H����2e����Pb2����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�2SO2(g)��O2(g)![]() 2SO3(g)����Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2(g)����Ϊ1 mol SO3(g)�ġ�H����99��kJ��mol��1��
2SO3(g)����Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2(g)����Ϊ1 mol SO3(g)�ġ�H����99��kJ��mol��1��

��1��ͼ�С�H��___________kJ��mol��1������ֵ����
��2��д��SO3(g)�ֽ��SO2(g)��O2(g)���Ȼ�ѧ����ʽ��_____________________��
��3�����������V2O5����ʹͼ��B��___________������ߡ����͡�����
��4���ӻ�ѧ���Ƕȷ�����E��ʾ�����壺______________________________��
��5��ij��ҵ����ʵ���������£�
�¶� | ѹǿ��ͬʱSO2��ת���ʣ�%�� | ||||
1.01��105 Pa | 5.05��105 Pa | 1.01��106 Pa | 5.05��106 Pa | 1.01��107 Pa | |
450�� | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550�� | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
����Ϊ�����˵�������______________________��
��6����֪��S(s)����3 mol SO3(g)���ų�1185 kJ���������������ȼ����Ϊ_____kJ��mol��1��
��7��β��SO2�����ð�ˮ���ճ�ȥ��
��֪25��ʱ��NH3��H2O ��Kb��1.8��10��5��H2SO3��Ka1��1.3��10��2��Ka2��6.2��10��8��
������ˮ��Ũ��Ϊ2.0 mol/L����Һ�е�c(OH��)��___________mol/L��
�ڽ�SO2 ͨ��ð�ˮ�У���c(OH��)����1.0��10��7 mol/Lʱ����Һ�е�c(SO32��)/c(HSO3��)��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2 L������A��B�������ʼ��ת����Ӧ�У�A��B���ʵ�����ʱ��仯��������ͼ��ʾ����ͼ�����ݷ����ã�

��1���÷�Ӧ�Ļ�ѧ����ʽΪ___________________��
��2����Ӧ��ʼ��4 minʱ��A��ƽ����Ӧ����Ϊ____________________________��
��3��4 minʱ����Ӧ�Ƿ�ﵽƽ��״̬��________(����������������)��8 minʱ��v(��)________v(��) (������������������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪1 g������ȫȼ������ˮ����ʱ�ų�����121 kJ����������1 mol O=O����ȫ����ʱ��������496 kJ��ˮ������1mol H-O���γ�ʱ�ų�����463 kJ����������1mol H-H������ʱ��������Ϊ
A.920 kJB.557 kJC.436 kJD.188 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ������������ǿ��������ܰ�ϸ����ֳ�����ã���ͨ�����·�Ӧ�Ƶã�

����������ȷ����
A. ����ˮ�ɼ�����X��Z B. ������Y�ķ���ʽΪC6H13NO2
C. ������Z�к�������̼ԭ�� D. 1mol������Z������3mol NaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����ȿ���CO��CO2��Ӧ�öԹ�����̬������������Ҫ�����塣
(1)CO2��H2��ֱ�Ӻϳɼ״�����һ�ܱ������г���CO2��H2��������Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H= a kJ/mol
CH3OH(g)+H2O(g) ��H= a kJ/mol
�ٱ����¶ȡ����һ������˵��������Ӧ�ﵽƽ��״̬����________��
A��������ѹǿ���� B��3v��(CH3OH)= v��(H2)
C��������������ܶȲ��� D��CO2��H2O�����ʵ���֮�ȱ��ֲ���
�ڲ�ò�ͬ�¶�ʱCH3OH�����ʵ�����ʱ��ı仯��ͼ��ʾ����a______0(����>������<��)��

(2)��ҵ��������Կ����е�CO���м�⡣
���Ȼ���(PdCl2)��Һ���Լ��������������CO���������к�COʱ����Һ�л������ɫ��Pd����������Ӧ����0.02 mol����ת�ƣ�������Pd����������Ϊ________��
��ʹ�õ绯ѧһ����̼���崫����������������CO��������ģ����ͼ��ʾ�����ִ�����������ԭ���ԭ������õ�صĸ�����ӦʽΪ________��

(3)ij�����ɽ�CO2��CH4ת�������ᡣ�����Ĵ�Ч�ʺ�����������������¶ȵı仯��ϵ��ͼ��ʾ�����������������Ҫȡ�����¶�Ӱ��ķ�Χ��________��

(4)�����£���һ������CO2ͨ��ʯ�����г�ַ�Ӧ����ƽ�����Һ��pHΪ11����c(CO32-)=_______��(��֪��Ksp[Ca(OH)2]=5.6��106��Ksp(CaCO3) =2.8��109)
(5)��ȼú�����Ķ�����̼�������ã��ɴﵽ��̼�ŷŵ�Ŀ�ġ�ͼ4��ͨ�����ת��ԭ��������ԭ���Ʊ��²�Ʒ��ʾ��ͼ������a��b֮�����ӵ����ϵ�������������_______(����a��b������b��a��)

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com