
����Ŀ��I.��ȩ��ľ�ļӹ���ҽҩ�ȷ�������Ҫ��;���״�ֱ�������ǹ�ҵ�Ϻϳɼ�ȩ���·������Ʊ������漰����Ҫ��Ӧ���£�
��ӦI��CH3OH(g)![]() HCHO(g)+H2(g) ��H1=+85.2kJ/mol
HCHO(g)+H2(g) ��H1=+85.2kJ/mol
��ӦII��CH3OH(g)+![]() O2(g)
O2(g)![]() HCHO(g)+H2O(g) ��H2
HCHO(g)+H2O(g) ��H2
��ӦIII��2H2(g)+O2(g)![]() 2H2O(g) ��H3=-483.6kJ/mol
2H2O(g) ��H3=-483.6kJ/mol
(1)���㷴Ӧ��ķ�Ӧ����H2=_____________________________��
(2)750K�£��ں����ܱ������У�������ӦCH3OH(g)![]() HCHO(g)+H2(g��������ʼѹǿΪP0���ﵽƽ��ת����Ϊ������ƽ��ʱ����ѹǿPƽ=___________(�ú�P0������ʽ�ӱ�ʾ)����P0=101kPa�������=50.0%�����㷴Ӧƽ�ⳣ��Kp=___________kPa(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������������Ӧ)��
HCHO(g)+H2(g��������ʼѹǿΪP0���ﵽƽ��ת����Ϊ������ƽ��ʱ����ѹǿPƽ=___________(�ú�P0������ʽ�ӱ�ʾ)����P0=101kPa�������=50.0%�����㷴Ӧƽ�ⳣ��Kp=___________kPa(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������������Ӧ)��
II.CO2�����������壬Ҳ����Ҫ�Ļ���ԭ�ϣ���CO2Ϊԭ�Ͽɺϳɶ����л��
(3)CO2����������ϩ����֪��2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ��H��QkJ/mol��һ�������£�����ͬ��Ͷ�ϱ�X[X��
CH2=CH2(g)+4H2O(g) ��H��QkJ/mol��һ�������£�����ͬ��Ͷ�ϱ�X[X��![]() ]��ij�ݻ��ɱ�ĺ�ѹ�ܱ������г���CO2��H2����ò�ͬͶ�ϱ�ʱCO2��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
]��ij�ݻ��ɱ�ĺ�ѹ�ܱ������г���CO2��H2����ò�ͬͶ�ϱ�ʱCO2��ת�������¶ȵĹ�ϵ��ͼ��ʾ��

��X1_____X2����������������������ͬ����Q_____0��
��ͼ��A��B��C�����Ӧ��ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵΪ_____��
(4)�����£���NaOH��Һ��CO2�����������Խ���̼�ŷţ����ҿɵõ���Ҫ�Ļ�����ƷNa2CO3��
����ij�β���õ�pH��10����Һ������Һ��c(CO32-)��c(HCO3-)=_____[������K1(H2CO3)=4.4��10��7��K2(H2CO3)=5��10��11]��
������5L Na2CO3��Һ��23.3g BaSO4����ȫ��ת��ΪBaCO3�������õ�Na2CO3��Һ�����ʵ���Ũ������Ϊ__________��[��֪��������Ksp(BaSO4)=1��10��7��Ksp(BaCO3)=2.5��10��6]��(������Һ������ı仯)
���𰸡�-156.6kJ/mol P0(1+��) 50.5 > < KA>KB��KC 1��2 0.52mol/L
��������
(1)���ݸ�˹���ɣ���ӦI+![]() ��ӦIII�÷�Ӧ�ݴ˼�����H2��
��ӦIII�÷�Ӧ�ݴ˼�����H2��
(2)���ݺ���ʱ�����ѹǿ�ȵ�����������ʵ����ıȼ���ƽ��ʱ��ѹǿ������ƽ�ⳣ������ʽ������ƽ�ⳣ����
(3)�ٵ���������һ��ʱ�������H2��Խ�࣬CO2ת����Խ�ߣ���Ӧ��XԽ����X1��X2����������������ʱ�����ͼ���֪���¶����ߣ�CO2��ת���ʽ��ͣ�����֪�÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ���ݴ˽��з�����
�ڽ��ͼ���֪�÷�Ӧ����ӦΪ���ȷ�Ӧ�����¶����ߣ���ѧƽ�ⳣ������С�����һ�ѧƽ�ⳣ��ֻ���¶��йأ�
(4)��������pH=10���ɼ���c(H+)=1��10-10mol/L����HCO3-![]() CO32-+H+�ɵã�Ka2=
CO32-+H+�ɵã�Ka2=![]() =5��10��11������
=5��10��11������![]() =1��2��
=1��2��
����������Ҫ���ʵ���Ũ��Ϊxmol/L��Na2CO3��Һ����BaSO4��ȫ�ܽ��23.3g BaSO4�����ʵ���Ϊn(BaSO4)= 23.3g��233g/mol=0.1mol������5L��Һ��c(SO42-)=0.1mol ��5L=0.02mol/L����ʱ��Һ��c(CO32-)=(x-0.02)mol/L����BaSO4+CO32-=BaCO3+SO42-��֪���˷�Ӧ�Ļ�ѧƽ�ⳣ��K=![]() =0.04=
=0.04=![]() ���ݴ˽��м��㡣
���ݴ˽��м��㡣
(1)I+![]() ��III�������ɵ�CH3OH(g)+
��III�������ɵ�CH3OH(g)+![]() O2(g)
O2(g)![]() HCHO(g)+H2O(g) ��H2=��H1+
HCHO(g)+H2O(g) ��H2=��H1+![]() ����H3=-156.6kJ/mol��
����H3=-156.6kJ/mol��
(2)�����ں���ʱ�����ѹǿ�ȵ�����������ʵ����ıȼ���ƽ��ʱ��ѹǿ������ʼѹǿΪP0���ﵽƽ��ת����Ϊ����
CH3OH(g)![]() HCHO(g)+H2(g)
HCHO(g)+H2(g)
��ʼ(mol) 1 0 0
�仯(mol) a a a
ƽ��(mol) 1-a a a
ѹǿ֮�ȵ������ʵ���֮�ȣ���p0��Pƽ=1(1+a)��Pƽ=p0(1+a)����P0=101kPa�������=50.0%���÷�Ӧƽ�ⳣ��Kp=![]() =50.5 kPa��
=50.5 kPa��
(3)�ٵ���������һ��ʱ�������H2��Խ�࣬CO2ת����Խ�ߣ���Ӧ��XԽ����X1>X2����������������ʱ�����ͼ���֪���¶����ߣ�CO2��ת���ʽ��ͣ�����֪�÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ����Q��0��
�ڽ��ͼ���֪�÷�Ӧ������ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ����÷�Ӧ�Ļ�ѧƽ�ⳣ����С�����һ�ѧƽ�ⳣ��ֻ���¶��йأ�����ͼ��֪A����¶ȵ���B��C���㣬����B��C�����¶���ͬ���������Ӧ��ƽ�ⳣ���Ĵ�С��ϵΪ��KA>KB=KC��
(4)��)��������pH=10���ɼ���c(H+)=1��10-10mol/L����HCO3-![]() CO32-+H+�ɵã�Ka2=
CO32-+H+�ɵã�Ka2=![]() =5��10��11������
=5��10��11������![]() =1��2��
=1��2��
����������Ҫ���ʵ���Ũ��Ϊxmol/L��Na2CO3��Һ����BaSO4��ȫ�ܽ��23.3g BaSO4�����ʵ���Ϊn(BaSO4)= 23.3g��233g/mol=0.1mol������5L��Һ��c(SO42-)=0.1mol ��5L=0.02mol/L����ʱ��Һ��c(CO32-)=(x-0.02)mol/L����BaSO4+CO32-=BaCO3+SO42-��֪���˷�Ӧ�Ļ�ѧƽ�ⳣ��K=![]() =0.04=
=0.04=![]() ��
��
����������Ҫ���ʵ���Ũ��Ϊxmol/L��Na2CO3��Һ����BaSO4��ȫ�ܽ������5L��Һ��c��SO42-��=0.02mol/L����ʱ��Һ��c(CO32-)=(x-0.02)mol/L����BaSO4+CO32-=BaCO3+SO42-��֪���˷�Ӧ�Ļ�ѧƽ�ⳣ��K=![]() =0.04=
=0.04=![]() �����x=0.52mol/L��
�����x=0.52mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ΪӦ��ȫ��ʯ����Դ�����ȱ�����ú������Ч�ʣ��ҹ�������ú���������������빤ҵ������Ρ�
(1)ú�����ƺϳ���(CO��H2)��C(s)+H2O(g)=CO(g)+H2(g) ��H=+131.3kJ/mol�÷�Ӧ�ڸ��������Է����У�������_____________��
(2)�ɺϳ����Ƽ״����ϳ���CO��H2��һ���������ܷ������·�Ӧ��
����ӦI��CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ӦII��CO(g)+H2(g)![]() C(s)+H2O(g)
C(s)+H2O(g)
�����ݻ���ΪVL�ļס��ҡ��������ܱ������зֱ����amolCO��2 amolH2�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3(T1<T2��T3)�Һ㶨���䣬��ֻ������ӦI��������������ͬ������£�ʵ���÷�Ӧ�����е�tminʱCO�����������ͼ��ʾ����ʱ����������һ�����ڻ�ѧƽ��״̬����_____���T1������T2����T3���������¶��µĻ�ѧƽ�ⳣ��Ϊ_____����a��V��ʾ����

��Ϊ��������Ӧ�ķ��������в�ȡ�Ĵ�ʩ��������______��
A.��Ӧǰ����������ˮ���� B.��ѹ
C.���ͷ�Ӧ�¶� D.ʹ�ú��ʴ�������״���ѡ����
(3)�ɼ״���ϩ��
����Ӧ��i.2CH3OH![]() C2H4+2H2O
C2H4+2H2O
ii.3CH3OH![]() C3H6+3H2O
C3H6+3H2O
����Ӧ��iii.2CH3OH![]() CH3OCH3��H2O
CH3OCH3��H2O
ijʵ���ҿ��Ʒ�Ӧ�¶�Ϊ400�棬����ͬ�ķ�Ӧ��ϵ�зֱ���װ���������ִ���(Cat��1��Cat.2)���Ժ㶨������ͨ��CH3OH������ͬ��ѹǿ�½������ִ����ϼ״���ϩ���ĶԱ��о����õ���ͼʵ�����ݣ���ѡ���ԣ�ת���ļ״���������ϩ�ͱ�ϩ�İٷֱȣ�


����˵������ȷ����_________��
A.��Ӧ����һ��ʱ���״���ת���ʼ�С�����ܵ�ԭ���Ǵ���ʧ���ҵ�������趨�ڸ�������
B.ʹ��Cat.2��Ӧ2h����ϩ����ϩ��ѡ�����½������ܵ�ԭ�������ɸ����������
C.ʹ��Cat.1������ϩ����ҪΪ��ϩ��ʹ��Cat.2������ϩ����ҪΪ��ϩ
D.����ʹ��Cat.1����ʹ��Cat.2���������ӵİٷ���
(4)��֪��2CrO42-+2H+![]() Cr2O72-+H2O���Ը����Ϊԭ�ϣ��绯ѧ�����ظ���ص�ʵ��װ��ʾ��ͼ����
Cr2O72-+H2O���Ը����Ϊԭ�ϣ��绯ѧ�����ظ���ص�ʵ��װ��ʾ��ͼ����

��aΪ��Դ��________������������������������
�ڸ��Ʊ������ܷ�Ӧ�Ļ�ѧ����ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ý���ʵ�飬���ش��������⡣

��ͭƬ�ϵ�������__________________________ ���缫��ӦΪ________________ ��_____________���пƬ����ͭƬ����ֻ�����ӵ����á�
�Ƶ�����_____________����������_____________ ��_____________Ϊ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǵڶ����ڲ���Ԫ�ػ�̬ԭ�ӵĵ����Ų�ͼ���ݴ�����˵���������(����)


A. ÿ��ԭ�ӹ�������ֻ������2������
B. ��������ͬһ�ܼ�ʱ���������ȵ���ռ��һ�����
C. ÿ���ܲ������е��ܼ��������ܲ������(n)
D. ��ԭ�ӹ������2�����ӣ���������״̬�෴
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��һ����Һ̬��(N2H4)Ϊȼ�ϣ�����Ϊ��������ij����������Ϊ����ʵ�����ȼ�ϵ�ء��ù������������ʵĹ����¶ȸߴ�700��900��ʱ��O2-���ڸù��������������������ƶ�����Ӧ�������Ϊ���������ʡ�����˵����ȷ����

A. ����ܷ�ӦΪ��N2H4+2O2=2NO+2H2O
B. ����ڵ�O2-�ɵ缫������缫��
C. ���缫����lmol N2H4����ʱ���ҵ缫����22.4LO2���뷴Ӧ
D. �����������ʽΪ��O2 + 4e-+2H2O=4OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��O3�������к������ߣ�����������������Ŀռ䡣O3�ķ��ӽṹ��ͼ����V�Σ��������ļн�Ϊ116.5�㣬����ԭ����һ��Oԭ��Ϊ���ģ�����������Oԭ�ӷֱ�һ�����ۼ����м�Oԭ���ṩ�������ӣ��Ա�����Oԭ�Ӹ��ṩһ�����ӣ�����һ������Ļ�ѧ����������Oԭ�Ӿ��ȵ�������Щ���ӡ���ش�

(1)������������Ϊ________________��
(2)���з�����O3���ӵĽṹ�����Ƶ���________��
A�� H2O B�� CO2 C�� SO2 D�� BeCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ�ۻ�ѧ�о������������У�������ǣ� ��
A. �ڻ���������Ӧ��ѭ����ɫ��ѧ����˼��
B. �ڹ���Ԫ����Ѱ�������Ĵ���
C. ��Ԫ�����ڱ��Ľ����ͷǽ����ֽ��߸���Ѱ�Ұ뵼�����
D. ����Ԫ�������ɣ���HClO4�������Ƴ���Ԫ�ص�����������ˮ����ΪHFO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��¯�ڱڵ�ˮ���������˷�ȼ�ϣ���������������ȫ������ij̼�ظֹ�¯ˮ��(��Ҫ�ɷ���CaCO3��CaSO4��Mg(OH)2��Fe2O3��SiO2��)����������������£�

��֪��20��ʱ������������ܶȻ��������±�(��λʡ��)��

�ش��������⣺
(1)�����������ڣ�����Na3PO4����ҪĿ���ǽ�CaSO4ת��ΪCa3(PO4)2����д�������ӷ���ʽ______________________��
(2)�����ݹ����У�ϡ������ܽ�Fe2O3���ܽ���Fe2O3����ٹ�¯��ʴ����������ԭ��������
�ٹ�¯�����ٸ�ʴ��ԭ����______________________��
�ڽ���Һ��ԭ������ʱ��Sn2+ת��ΪSn4+����Ӧ���������뻹ԭ�������ʵ���֮��Ϊ______________________��
(3)���ۻ���������Ŀ�����ڹ�¯�����γ�Fe3O4����Ĥ��ͬʱ���ɿ�ֱ�Ӳ������ѭ�������塣
�ٷ�Ӧ�����ӷ���ʽΪ_________________________________��
��Ϊ�����¯���ۻ����������Ƿ��γ����ܵı���Ĥ��������¯�ڱ�ˢ������ͭ��Һ�����۲쵽______________________(������)����Ĥ������Ƿ�ѡ�
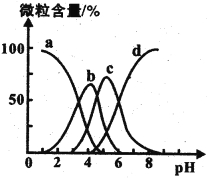
(4)������(��H3R��ʾ)�����������¯ˮ������ϴ������Һ��H3R��H2R����HR2����R3���ĺ�����pH�Ĺ�ϵ��ͼ��ʾ���ɴ˿���֪��0.1 mol ��L��1 Na2HR��Һ�и���������Ũ���ɴ�С������˳��Ϊ______________________��
(5)����ͼװ�öԹ�¯��ˮ(��Ca2+��Mg2+��HCO3��)����Ԥ����������Ч��ֹˮ���γɡ����ʱ��Ca2+�γɳ����ĵ缫��ӦʽΪ______________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���̼������Ľṹ�����ʣ������������еȾ�����Ҫ����
(1)�������ɶ����Ԫ������֮��ʧˮ�γɵĻ�״�����X��Y��Z�dz��������ֹ��ѣ���ṹ��ͼ��ʾ���������������������ã��������Ż��Ĵ�С��ͬ���벻ͬ�����������á�

��Li+����X�Ŀ�ǻ��С�����ǡ���ܽ��뵽X�Ļ��ڣ���Li+����ԭ�ӵ�һ�Թµ��Ӷ������γ��ȶ��ṹW(��ͼ)��
a.��̬����Ӻ���������ߵĵ��������ܲ����Ϊ___________��
b.W��Li+��¶Ե���֮�����������___________(ѡ����ĸ���)
A.���Ӽ� B.���ۼ� C.��λ�� D.��� E.���϶�����
�ڹ���Y����K+�γ��ȶ��ṹ����������Li+���γ��ȶ��ṹ��������___________��
��ϩ��������ˮ����KMnO4ˮ��Һ������Ч���ϲ��ϩ�������˹���Z������Ч������������
i.ˮ�����������ӻ�����Ŀռ乹����___________��H��O������___________(������������������=��)109��28��
ii.��֪������Z��KMnO4���Է�����ͼ��ʾ�ı仯���������Z��ϩ��������Ч������������ԭ����___________��
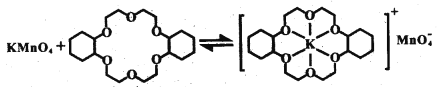
(2)��������Ҫ�������Դ���侧��ṹ��ͼ��ʾ����������Ϊanm��
�ٳ��³�ѹ�²����ڼ��龧�塣����������õĽǶȽ��ͣ���������___________��
�ڼ�����ӵ���λ��Ϊ___________��
��A������̼ԭ�ӵ��������Ϊ(0��0��0)����B���ӵ�̼ԭ�ӵ��������Ϊ___________��
�ܼ��龧����ܶ�Ϊ___________(g��cm��3)��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com