
【题目】![]() 代表阿伏加德罗常数的值,下列叙述正确的是( )
代表阿伏加德罗常数的值,下列叙述正确的是( )
A.1mol ![]() 中含有
中含有![]() 个
个![]()
B.4.6g分子式为![]() 的有机物中碳氢键数目一定是
的有机物中碳氢键数目一定是![]()
C.电解精炼铜中转移1mol电子,阳极质量减少32g
D.将含0.1mol![]() 的饱和溶液滴入沸水中,形成的胶体粒子的数目少于
的饱和溶液滴入沸水中,形成的胶体粒子的数目少于![]()
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素 W、X、Y、Z 的原子序数依次增大,X 的质子数是 W 与 Z 的质子数之和的一半。m、n、p 是由这些元素组成的二元化合物,r 是元素 Y 的气体单质,n 为淡黄色粉末, 相关物质转化关系如图所示。室温下,0.01mol/L s 溶液 pH 为 12。下列说法误错的是
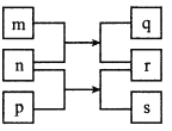
A.Z 是所在周期中原子半径最大的元素
B.简单离子半径大小:Y﹥Z﹥W
C.电负性:Y﹥X﹥W
D.n 中阴阳离子个数比为 1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。

(1)装置C中盛装的溶液是____________,D中试剂的作用是________。
(2)E中的红色布条是否退色?____,写出F中反应的化学反应方程式:____,其反应现象为_____________。
(3)新制氯水呈黄绿色说明其中含有_____,(填化学式,下同),将紫色石蕊溶液滴入可观察到的现象是_________________,说明其中含有__________。
(4)H中的试剂为___________,用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白精,该反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向Ba(OH)2和NaOH混合溶液中缓慢通入CO2至过量(溶液温度变化忽略不计),生成沉淀物质的量与通入CO2体积的关系如图所示。下列说法不正确的是
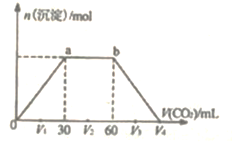
A. b点时溶质为NaHCO3
B. 横坐标轴上V4的值为90
C. oa过程是CO2与Ba(OH)2反应生成BaCO3的过程
D. 原混合物中 n[Ba(OH)2]:n(NaOH)=1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝土矿和黄铁矿的共生矿(主要成分为Al2O3、FeS2和SiO2),由此矿石制备Fe3O4和Al2O3的流程如下图所示,回答下列问题:
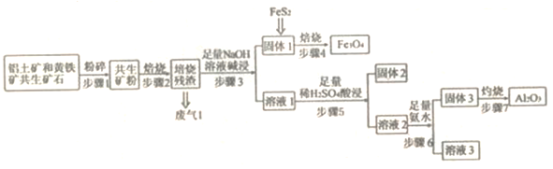
(1)“步骤2”焙烧过程产生的废气为 _________。
(2)已知“步骤4”隔绝空气焙烧,则化学方程式为________(已知该过程产生的废气和废气1成分相同)。
(3)“固体2”的成分是_________,步骤5的分离方法是_________。
(4)写出步骤5的离子方程式__________。
(5)若原矿石质量为bkg,经过该过程获得的Fe3O4的质童为akg,则原矿石中铁元素的质量分数为________。
(6)该流程中存在较为明显的缺陷是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)还原铁粉与高温水蒸气反应的化学方程式:_____________________________________;
(2)除去Mg粉中的Al粉的试剂是__________ ,反应的离子方程式为:____________;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH- =__FeO42-+___Cl-+__(_______)
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是________________;还原剂是_______________;当有11molP参加反应,转移的电子的物质的量为________;1molCuSO4能氧化的P原子的数目为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列九种物质:①HCl气体 ②Cu ③蔗糖 ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦氯酸钾溶液 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)属于电解质的是___;属于非电解质的是___。
(2)②和⑧反应的化学方程式为:3Cu +8HNO3=3Cu(NO3)2+2NO↑+4H2O
上述反应中氧化产物是___。硝酸没有全部参加氧化还原反应,参加氧化还原反应的硝酸占总硝酸的___。用双线桥法分析上述反应(只需标出电子得失的方向和数目)___。3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(3)上述九种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为___。
(4)⑨在水中的电离方程式为___,
(5)34.2g⑨溶于水配成1000mL溶液,SO42-的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
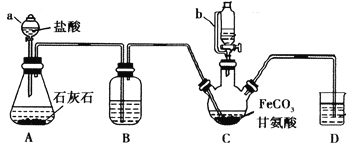
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com