
| A. | 大于10.00mL | B. | 小于10.00Ml | C. | 等于10.00mL | D. | 不能确定 |
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 将两种溶液都稀释100倍,醋酸的pH大于盐酸 | |
| B. | 用相同浓度的氢氧化钠溶液中和,消耗氢氧化钠的体积相等 | |
| C. | 分别加入质量相同的足量锌粉,开始时盐酸反应速率快 | |
| D. | 盐酸的浓度为0.01mol•L-1,醋酸浓度大于0.01mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
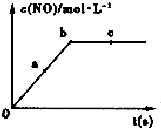 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:| 深度/mol•L-1 时间/min | C(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | 4.5 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
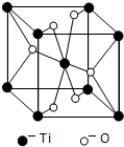
| 元素 | Mn | Fe | |
| 电离能/mol | I1 | 717 | 758 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | Ⅳ | ⅤA | ⅥA | ⅦA | 0 | |
| 二周期 | ① | ② | | |||||
| 三周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 ,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.
,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水能跟氯化铁溶液反应生成氢氧化铁 | |
| B. | 铵盐受热易分解 | |
| C. | 0.1 mol/L氯化铵溶液的pH约为5 | |
| D. | 0.1 mol/L氨水可使酚酞试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ | |
| B. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在K+、Na+ | |
| C. | c(CO32-)=0.01 mol•L-1,c(NH4+)>c(SO42-) | |
| D. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正极反应为Cl2+2e-=2Cl- | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.01 mol离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com