

| A. | 正极反应为Cl2+2e-=2Cl- | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.01 mol离子 |
分析 根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A、正极上氯气得电子;
B、放电时,交换膜左则的氢离子向正极移动,氯离子向负极移动;
C、根据电池总反应判断;
D、放电时,交换膜左侧溶液中生成银离子.
解答 解:根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A、正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e-═2Cl-,故A正确;
B、放电时,交换膜左则的氢离子向正极移动,所以H+从左侧经阳离子交换膜移向右侧,氯离子向负极(左侧)移动,与负极产物生成白色沉淀氯化银,故B错误;
C、根据电池总反应为2Ag+Cl2═2AgCl可知,用NaCl溶液代替盐酸,电池的总反应不变,故C错误;
D、放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中共约减少0.02mol离子,故D错误;
故选A.
点评 本题考查了原电池原理的应用及沉淀反应,注意把握原电池原理及正负极的判断和电极方程式的书写,利用电子及电荷守恒来解决原电池中有关计算的问题,题目难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 大于10.00mL | B. | 小于10.00Ml | C. | 等于10.00mL | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸中逐滴加入食盐溶液 | B. | 硫酸中逐滴加入氢氧化钠溶液 | ||
| C. | 石灰乳中滴加稀盐酸 | D. | 硫酸中逐滴加入氢氧化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
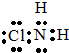 ,从物质结构的角度解释两者熔点相差较大的原因氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,熔沸点离子晶体高于分子晶体.
,从物质结构的角度解释两者熔点相差较大的原因氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,熔沸点离子晶体高于分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
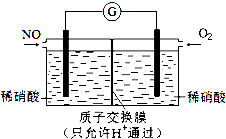 NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.
NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水是强电解质 | B. | 25℃时,纯水的pH=7 | ||
| C. | 可燃冰是可以燃烧的水 | D. | 氢氧两种元素只能组成水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .甲溶液含有OH- | B. | .乙溶液含有H+ | C. | 丙溶液含有HCO3- | D. | .丁溶液含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固态氯化钠不导电,所以NaCl是非电解质 | |
| B. | 氨气的水溶液能导电,所以氨气是电解质 | |
| C. | SO3溶于水能导电,是因为SO3在水中发生了电离 | |
| D. | 液态氯化氢不导电,但是HCl是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com