
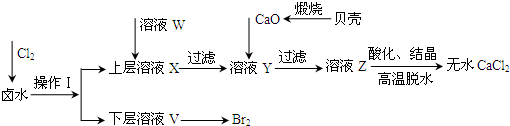
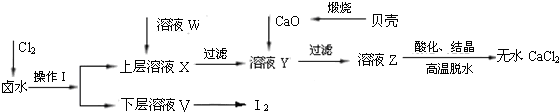
实验室以含有Ca2+、Mg2+、Cl‾、SO42‾、Br‾等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
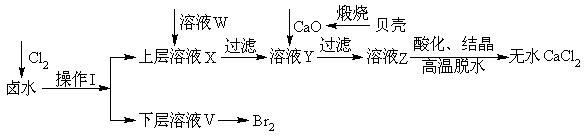
(1)操作I使用的试剂是______________,所用主要仪器的名称是__________________。
(2)加入溶液W的目的是____________________________。用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择pH最大范围是__________________。酸化溶液Z时,使用的试剂为____________。
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | C(OH‾)=1.8 mol•L‾1 |
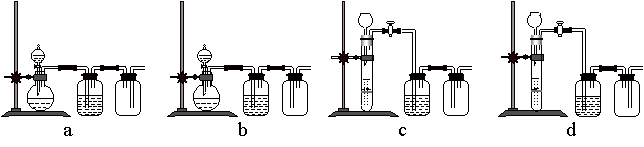
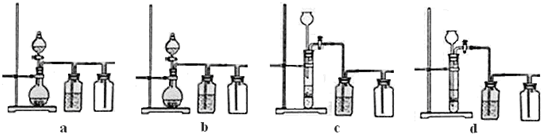
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是______。
(4)常温下,H2SO3的电离常数Ka1=1.2×10‾2,Ka2=6.3×10‾8,H2CO3 的电离常数Ka1=4.5×10‾7,Ka2=4.7×10‾12。某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于__________________。
设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论,仪器自选)。
供选的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHCO3、蒸馏水、饱和石灰水、酸性 溶液、品红溶液、pH试纸。
_______________________________________________________________________________________。
答案:(1)四氯化碳 分液漏斗
(2)除去溶液中的SO42‾ 11.0<pH<12.2 盐酸
(3)b、d
(4)用于比较pH的两种酸的物质的量浓度不相等 提供3种参考方案如下:
方案一:配制相同物质的量浓度相同的NaHSO3和NaHCO3溶液,用酸度计(或pH试纸)测两溶液的pH,前者的pH小于后者,证明H2SO3酸性强于H2CO3。
方案二:将SO2气体依次有过NaHCO3(或Na2CO3)溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,品红溶液不褪色且澄清石灰水变浑浊,证明H2SO3酸性强于H2CO3。
方案三:将CO2气体依次有过NaHSO3(或Na2SO3)溶液、品红溶液,品红溶液不褪色,证明H2SO3酸性强于H2CO3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 现象 | 结论 |
将SO2依次通过 NaHCO3或Na2CO3溶液、 酸性KMnO4溶液、 品红溶液、 澄清石灰水 将SO2依次通过 NaHCO3或Na2CO3溶液、 酸性KMnO4溶液、 品红溶液、 澄清石灰水 |
NaHCO3或Na2CO3溶液有气泡, 品红溶液不褪色, 澄清石灰水变浑浊 NaHCO3或Na2CO3溶液有气泡, 品红溶液不褪色, 澄清石灰水变浑浊 |
H2SO3酸性强于H2CO3 |
查看答案和解析>>
科目:高中化学 来源:山东省高考真题 题型:推断题






查看答案和解析>>
科目:高中化学 来源: 题型:
实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:

(1)操作Ⅰ使用的试剂是______,所用的主要仪器名称是_______。
(2)加入溶液W的目的是______。用CaO调节溶液Y的pH,可以除去Mg2+。酸化溶液Z时,使用的试剂为_____。
(3)实验室用贝壳与稀盐酸反应制备并收集气体,下列装置中合理的是______。

(4)工业规模海水提溴常用空气吹出法将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,请写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年天津一中高一(上)期末化学试卷(解析版) 题型:解答题


| 实验步骤 | 现象 | 结论 |
______ | ______ | H2SO3酸性强于H2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com