(2011?山东)实验室以含有Ca
2+、Mg
2+、Cl
-、SO
42-、Br
-等离子的卤水为主要原料制备无水CaCl
2和Br
2,流程如下:
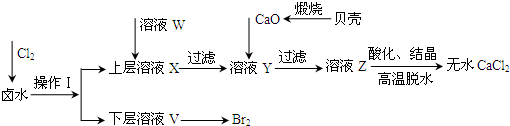
(1)操作Ⅰ使用的试剂是
四氯化碳
四氯化碳
,所用的主要仪器名称是
分液漏斗
分液漏斗
.
(2)加入溶液W的目的是
除去溶液中SO42-
除去溶液中SO42-
.用CaO调节溶液Y的pH,可以除去Mg
2+.由表中数据可知,理论上可选择的pH最大范围是
11.0≤pH≤12.2
11.0≤pH≤12.2
.酸化溶液Z时,使用的试剂为
盐酸
盐酸
.
|
开始沉淀时的pH |
沉淀完全时的pH |
| Mg2+ |
9.6 |
11.0 |
| Ca2+ |
12.2 |
c(OH-)=1.8mol?L-1 |
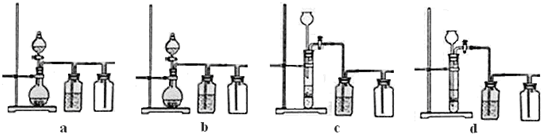
(3)实验室用贝壳与稀盐酸反应制备并收集气体,下列装置中合理的是
b、d
b、d
.
(4)常温下,H
2SO
3的电离常数K
a1=1.2×10
-2,K
a2=6.3×10
-8;H
2CO
3的电离常数K
a1=4.5×10
-7,K
a2=4.7×10
-11.某同学设计实验验证H
2SO
3酸性强于H
2CO
3:将SO
2和CO
2气体分别通入水中至饱和,立即用酸度计测量溶液的pH,若前者的pH小于后者,则H
2SO
3酸性强于H
2CO
3.该实验设计不正确,错误在于
用于比较pH的两种酸的物质的量浓度不相等
用于比较pH的两种酸的物质的量浓度不相等
.
设计合理实验验证H
2SO
3酸性强于H
2CO
3(简要说明实验步骤、现象和结论).
三种参考方案如下:
方案一:配制相同物质的量浓度的NaHSO3和NaHCO3溶液.用酸度计(或pH试纸)测两溶液的pH.前者的pH小于后者,证明H2SO3酸性强于H2CO3.
方案二:将SO2气体依次通过NaHCO3(或Na2CO3)溶液、酸性KMnO4溶液、品红溶液、澄清石灰水.品红溶液不褪色,且澄清石灰水变浑浊,证明H2SO3酸性强于H2CO3.
方案三:将CO2气体依次通过NaHSO3(或Na2SO3)溶液、品红溶液.品红溶液不褪色,证明H2SO3酸性强于H2CO3
三种参考方案如下:
方案一:配制相同物质的量浓度的NaHSO3和NaHCO3溶液.用酸度计(或pH试纸)测两溶液的pH.前者的pH小于后者,证明H2SO3酸性强于H2CO3.
方案二:将SO2气体依次通过NaHCO3(或Na2CO3)溶液、酸性KMnO4溶液、品红溶液、澄清石灰水.品红溶液不褪色,且澄清石灰水变浑浊,证明H2SO3酸性强于H2CO3.
方案三:将CO2气体依次通过NaHSO3(或Na2SO3)溶液、品红溶液.品红溶液不褪色,证明H2SO3酸性强于H2CO3
.
仪器自选.
供选择的试剂:CO
2、SO
2、Na
2CO
3、NaHCO
3、Na
2SO
3、NaHSO
3、蒸馏水、饱和石灰水、酸性KMnO
4溶液、品红溶液、pH试纸.





 (2011?山东)科研、生产中常涉及钠、硫及其化合物.
(2011?山东)科研、生产中常涉及钠、硫及其化合物.