
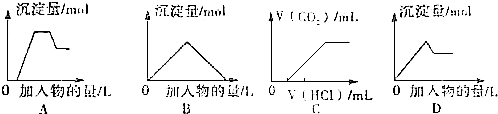
| A. | 图A表示想含OH-、AlO2-、CO32-、SiO32-、的溶液中滴加HCL溶液产生沉淀量的关系曲线 | |
| B. | 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 | |
| C. | 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 | |
| D. | 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线 |
分析 A.OH-、AlO2-、CO32-、SiO32-中加入氢离子,先与氢氧根离子反应,再与偏铝酸根离子反应、硅酸根离子反应生成沉淀,然后与碳酸根离子反应生成二氧化碳和水,最后生成的氢氧化铝与氢离子反应使部分沉淀溶解;
B.澄清石灰水中通入过量二氧化碳,先发生氢氧化钙与二氧化碳的反应生成碳酸钙沉淀,再发生碳酸钙与水、二氧化碳反应,沉淀消失,根据方程式判断前后两部分二氧化碳的物质的量关系;
C.向NaOH和Na2CO3的混合液中滴加盐酸,盐酸先和氢氧化钠反应,然后再与碳酸钠反应,先生成碳酸氢钠再生成氯化钠、水、二氧化碳;
D.向明矾溶液中逐滴加入Ba(OH)2溶液,当Al3+恰好全部沉淀时,反应生成硫酸钡、氢氧化铝、硫酸钾.
解答 解:A.含OH-、AlO2-、CO32-、SiO32-、的溶液中滴加HCL溶液,氢离子与氢氧根离子先反应生成水,开始没有沉淀,然后氢离子再与偏铝酸根离子反应、硅酸根离子反应生成沉淀,然后氢离子与碳酸根离子反应,沉淀量保持不变,最后生成的氢氧化铝与氢离子反应生成氯化铝,沉淀部分溶解,与A图象符合,故A正确;
B.向石灰水中通入二氧化碳:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,先产生沉淀,后沉淀溶解,所用二氧化碳体积为1:1,与B图象符合,故B正确;
C.向NaOH和Na2CO3的混合液中滴加盐酸,盐酸先和氢氧化钠反应,开始没有气体,然后再与碳酸钠反应,Na2CO3+HCl=NaHCO3+NaCl,NaHCO3++HCl=NaCl+CO2↑+H2O,产生CO2气体,开始未产生气体消耗的盐酸应比产生气体消耗的盐酸多,图象错误,故C错误;
D.向明矾溶液中逐滴加入Ba(OH)2溶液,当Al3+恰好全部沉淀时,离子方程式为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓,继续滴加,则发生Al3++4OH-═AlO2-+2H2O,与D图象符合,故D正确;
故选:C.
点评 本题以图象为载体考查了物质之间的反应,明确发生的化学反应是解答的关键,反应发生的先后顺序是学生解答中的难点,注意图象比例关系,题目难度中等.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
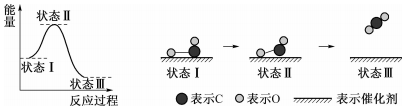
| A. | 状态Ⅰ→状态Ⅲ是放热过程 | |
| B. | 该过程中,CO没有断键形成C和O | |
| C. | 状态Ⅰ→状态Ⅲ表示CO和O生成了CO2 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH}{→}$Na2SiO3(aq) | |
| B. | CuO$→_{△}^{H_{2}}$Cu$\stackrel{稀硫酸}{→}$CuSO4(aq) | |
| C. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO4 | |
| D. | NaCl饱和溶液$→_{②CO_{2}}^{①NH_{3}}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 | |
| 实验1 | 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 实验2 | 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 实验3 | 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①② | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl和37Cl的原子结构示意图相同 | |
| B. | 元素H只有11H和21H两种核素 | |
| C. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| D. | 1mol HCl分子和1mol HF分子断键需要的能量前者大于后者 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com