
【题目】甲、乙两容器都在进行A→B的反应,甲容器内每分钟减少4mol A,乙容器内每分钟减少2mol A,则甲容器内的反应速率与乙容器内的反应速率相比
A. 甲快 B. 甲慢 C. 相等 D. 无法判断快慢
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。实验室用干燥而纯净的氯气和二氧化硫合成硫酰氯,装置如图所示(夹持仪器已省略)

已知:①乙和丙装置作用为除去氯气中的杂质。
②氯气有毒,谨防泄漏,尾气需处理,不能随意排放。
③丁是制备氯气的装置。
④有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
请按要求填写下列问题:
(1)仪器A是一种冷凝管,其作用是可以使甲容器中挥发出的一些物质冷凝,再回到甲容器中。仪器A冷却水的进口为________(填“a”或“b”)。仪器B的作用是________________。
(2)装置丙的作用为除去Cl2中混有的部分HCl。整套装置中若缺少装置乙,根据已知信息判断能否成功制得硫酰氯?(填写能或者不能)____________________。
(3)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H===H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。从分解产物中分离出硫酰氯的方法是________。
(4)尝试写出本实验制取氯气的离子方程式________________________,可以看出被氧化的氯原子和被还原的氯原子的个数比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 电解饱和氯化钠溶液:2C1-+2H2O==H2↑+Cl2↑+2OH-
B. 氢氧化钡溶液与足量硫酸氢钠溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C. Na2O2与H2O反应制备O2:2O22-+2H2O=4OH-+O2↑
D. 向小苏打溶液中加入过量的澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关苯的结构与性质说法正确的是
A. 苯易溶于水
B. 苯分子中含有碳碳双键和碳碳单键
C. 苯能使溴水和酸性高锰酸钾溶液褪色
D. 苯在一定条件下能发生取代反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,由NO和CO组成的混合气体密度是H2的14.5倍,下列关系正确的是( )
A. 混合气体中,CO与NO质量比14:15
B. 混合气体中,CO与NO分子个数比1:2
C. 同温同压下,同体积的该混合气体与空气的质量不相等(空气平均相对分子质量为29)
D. 同温同压下,该混合气体的密度与空气的密度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有a mol/L 的NaX和b mol/L的NaY两种盐溶液。下列说法正确的是
A.若a=b且c(X-)= c(Y-)+ c(HY),则HX为强酸
B.若a=b且pH(NaX)>pH(NaY),则c(X-)+ c(OH-)> c(Y-)+ c(OH-)
C.若a>b且c(X-)= c(Y-),则酸性HX>HY
D.若两溶液等体积混合,则c(Na+)=(a+b) mol/L(忽略混合过程中的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用盖斯定律可方便地计算出难以通过实验直接测定的反应热。
已知:①P4(白磷,s)+5O2(g)![]() P4O10(s) ΔH=2 983.2 kJ·mol1
P4O10(s) ΔH=2 983.2 kJ·mol1
②P(红磷,s)+![]() O2(g)
O2(g)![]()
![]() P4O10(s) ΔH=738.5 kJ·mol1
P4O10(s) ΔH=738.5 kJ·mol1
则白磷转化为红磷的热化学方程式为
A.P4(白磷,s)![]() 4P(红磷,s) ΔH=29.2 kJ·mol1
4P(红磷,s) ΔH=29.2 kJ·mol1
B.P4(白磷,s)![]() 4P(红磷,s) ΔH=+29.2 kJ·mol1
4P(红磷,s) ΔH=+29.2 kJ·mol1
C.P4(白磷,s)![]() 4P(红磷,s) ΔH=2 244.7 kJ·mol1
4P(红磷,s) ΔH=2 244.7 kJ·mol1
D.P4(白磷,s)![]() 4P(红磷,s) ΔH=+2244.7 kJ·mol1
4P(红磷,s) ΔH=+2244.7 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
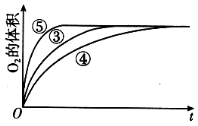
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________。
(2)实验①和②的目的是_____________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____________________。
(3)写出实验③的化学反应方程式:______________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com