
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________。
(2)实验①和②的目的是_____________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____________________。
(3)写出实验③的化学反应方程式:______________。
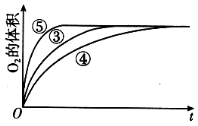
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是____________________________。
【答案】(1)改变反应途径,降低了活化能
(2)探究浓度对反应速率的影响
向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)
(3)2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
(4)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
【解析】(1)催化剂改变反应的途径,降低反应所需的活化能,从而加快反应速率。
(2)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)。
(3)过氧化氢在催化剂作用下分解生成水和氧气,该反应为2H2O2 ![]() 2H2O+O2↑。
2H2O+O2↑。
(4)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2 分解的速率。


科目:高中化学 来源: 题型:
【题目】甲、乙两容器都在进行A→B的反应,甲容器内每分钟减少4mol A,乙容器内每分钟减少2mol A,则甲容器内的反应速率与乙容器内的反应速率相比
A. 甲快 B. 甲慢 C. 相等 D. 无法判断快慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质:① NaOH 溶液 ② 液氨 ③BaCO3 固体 ④ 熔融KHSO4⑤ Fe ( OH )3胶体 ⑥ 铜 ⑦ CO2 ⑧ CH3COOH。
(1)以上物质中属于混合物的是_____(填序号)。以上物质中属于非电解质的是_____(填序号)。
(2)对物质⑤进行通电,观察到阴阳两极的现象是_____。以上纯净物中能导电的是_____(填序号)。
(3)写出①和⑧的水溶液反应的离子方程式________。
(4)写出④的电离方程式_____。
(5)在足量④的水溶液中加入少量③,发生反应的离子方程式为_____。
(6)在含0.4mol ①的溶液中缓缓通入标准状况下6.72LCO2,气体被全部吸收,则反应后溶液的溶质有_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2Fe2O3(s) +3C(s)=3CO2(g) +4Fe(s) △H=+468.2 kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
根据以上热化学方程式判断,下列说法正确的是 ( )
A. C(s)的燃烧热为393.5kJ
B. 右图可表示由C生成CO2的反应过程和能量关系
C. O2(g)与Fe(s)反应放出824.35kJ热量时,转移电子数为4NA
D. Fe2O3(s)+ ![]() C(g)=
C(g)= ![]() CO2(g)+2Fe(s) △H <234.1 kJ/mol
CO2(g)+2Fe(s) △H <234.1 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①CO(g) +H2O(g)=CO2(g)+H2(g) ΔH =-41.2 kJ· mol-1
②CH4(g) +H2O(g)=CO(g) +3H2(g)的能量变化如图所示: 下列有关说法正确的是( )
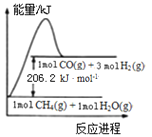
A. ①和②均为放热反应
B. ①的反应物总能量低于生成物总能量
C. CO2(g) +CH4(g)=2CO(g) +2H2(g) ΔH =-247.4 kJ· mol-1
D. CH4(g) +H2O(g)=CO(g) +3H2(g)的活化能大于206.2 kJ · mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.1mol/I.的NH4HCO3溶液中逐渐加入0.1mol/LNaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数)。根据图象,下列说法不正确的是( )
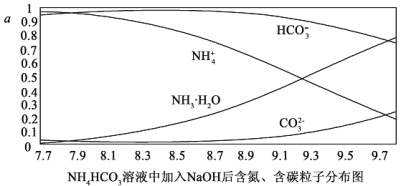
A.开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O
B.当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C.pH=9.5时,溶液中c(HCO3-)>c(HN3H2O)>c(NH4+)>c(CO32-)
D.滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 铝片与稀H2SO4反应 B. Ba(OH)2·8H2O与NH4Cl反应
C. 灼热的炭与CO2反应 D. 甲烷在O2中的燃烧反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com