
【题目】在工业上,下列金属的冶炼方法错误的是
A. 加热法冶炼汞 B. 电解法冶炼铝 C. 电解法冶炼铜 D. 热还原法冶炼铁
 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 电解饱和氯化钠溶液:2C1-+2H2O==H2↑+Cl2↑+2OH-
B. 氢氧化钡溶液与足量硫酸氢钠溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C. Na2O2与H2O反应制备O2:2O22-+2H2O=4OH-+O2↑
D. 向小苏打溶液中加入过量的澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有a mol/L 的NaX和b mol/L的NaY两种盐溶液。下列说法正确的是
A.若a=b且c(X-)= c(Y-)+ c(HY),则HX为强酸
B.若a=b且pH(NaX)>pH(NaY),则c(X-)+ c(OH-)> c(Y-)+ c(OH-)
C.若a>b且c(X-)= c(Y-),则酸性HX>HY
D.若两溶液等体积混合,则c(Na+)=(a+b) mol/L(忽略混合过程中的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用盖斯定律可方便地计算出难以通过实验直接测定的反应热。
已知:①P4(白磷,s)+5O2(g)![]() P4O10(s) ΔH=2 983.2 kJ·mol1
P4O10(s) ΔH=2 983.2 kJ·mol1
②P(红磷,s)+![]() O2(g)
O2(g)![]()
![]() P4O10(s) ΔH=738.5 kJ·mol1
P4O10(s) ΔH=738.5 kJ·mol1
则白磷转化为红磷的热化学方程式为
A.P4(白磷,s)![]() 4P(红磷,s) ΔH=29.2 kJ·mol1
4P(红磷,s) ΔH=29.2 kJ·mol1
B.P4(白磷,s)![]() 4P(红磷,s) ΔH=+29.2 kJ·mol1
4P(红磷,s) ΔH=+29.2 kJ·mol1
C.P4(白磷,s)![]() 4P(红磷,s) ΔH=2 244.7 kJ·mol1
4P(红磷,s) ΔH=2 244.7 kJ·mol1
D.P4(白磷,s)![]() 4P(红磷,s) ΔH=+2244.7 kJ·mol1
4P(红磷,s) ΔH=+2244.7 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH= 99 kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH= 99 kJ/mol。

请回答下列问题:
①图中A点表示: 。
C点表示: 。
E的大小对该反应的反应热 (填“有”或“无”)影响。
②图中ΔH = kJ/mol。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式: 。
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g)+![]() O2(g)
O2(g)![]() H2O( l )的ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
H2O( l )的ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中ΔH表示可燃物燃烧热的是( )
A. CO(g)+![]() O2(g)=CO2(g) ΔH=-283 kJ·mol-1
O2(g)=CO2(g) ΔH=-283 kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C. 2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
D. H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)![]() 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A. v(A)=0.15mol/(L·min) B. v (B)=0.6 mol/(L·min)
C. v (C)=0.3 mol/(L·min) D. v (D)=0.1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
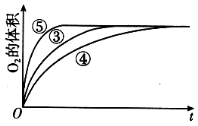
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________。
(2)实验①和②的目的是_____________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____________________。
(3)写出实验③的化学反应方程式:______________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com