
【题目】向0.1mol/I.的NH4HCO3溶液中逐渐加入0.1mol/LNaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数)。根据图象,下列说法不正确的是( )
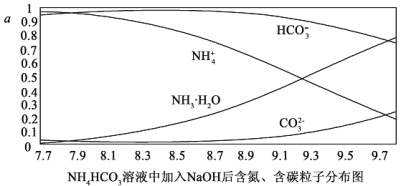
A.开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O
B.当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C.pH=9.5时,溶液中c(HCO3-)>c(HN3H2O)>c(NH4+)>c(CO32-)
D.滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3
【答案】D
【解析】
试题分析:NH4HCO3溶液中存在NH4+的水解平衡,即NH4++H2O![]() HN3H2O+H+①;HCO3-的水解平衡,即HCO3-+H2O
HN3H2O+H+①;HCO3-的水解平衡,即HCO3-+H2O![]() H2CO3+OH-②;HCO3-的电离平衡,即HCO3-
H2CO3+OH-②;HCO3-的电离平衡,即HCO3-![]() H++CO32-③;A.在未加氢氧化钠时,溶液的pH=7.7,呈碱性,则上述3个平衡中第②个HCO3-的水解为主,滴加氢氧化钠的开始阶段,氢氧根浓度增大,平衡②向逆方向移动,HCO3-的量略有增加,即逆方向的反应是H2CO3+OH-═HCO3-+H2O,故A正确;B.对于平衡①,氢氧根与氢离子反应,平衡正向移动,HN3H2O的量增加,NH4+被消耗,当pH大于8.7以后,CO32-的量在增加,平衡③受到影响,HCO3-被消耗,即碳酸氢根离子和铵根离子都与氢氧根离子反应,故B正确;C.从图中可直接看出pH=9.5时,溶液中c(HCO3-)>c(HN3H2O)>c(NH4+)>c(CO32-),故C正确;D.滴加氢氧化钠溶液时,HCO3-的量并没减小,反而增大,说明首先不是HCO3-与OH-反应,而是NH4+先反应,即NH4HCO3+NaOH═NaHCO3+NH3H2O,故D错误;故选D。
H++CO32-③;A.在未加氢氧化钠时,溶液的pH=7.7,呈碱性,则上述3个平衡中第②个HCO3-的水解为主,滴加氢氧化钠的开始阶段,氢氧根浓度增大,平衡②向逆方向移动,HCO3-的量略有增加,即逆方向的反应是H2CO3+OH-═HCO3-+H2O,故A正确;B.对于平衡①,氢氧根与氢离子反应,平衡正向移动,HN3H2O的量增加,NH4+被消耗,当pH大于8.7以后,CO32-的量在增加,平衡③受到影响,HCO3-被消耗,即碳酸氢根离子和铵根离子都与氢氧根离子反应,故B正确;C.从图中可直接看出pH=9.5时,溶液中c(HCO3-)>c(HN3H2O)>c(NH4+)>c(CO32-),故C正确;D.滴加氢氧化钠溶液时,HCO3-的量并没减小,反而增大,说明首先不是HCO3-与OH-反应,而是NH4+先反应,即NH4HCO3+NaOH═NaHCO3+NH3H2O,故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】现有a mol/L 的NaX和b mol/L的NaY两种盐溶液。下列说法正确的是
A.若a=b且c(X-)= c(Y-)+ c(HY),则HX为强酸
B.若a=b且pH(NaX)>pH(NaY),则c(X-)+ c(OH-)> c(Y-)+ c(OH-)
C.若a>b且c(X-)= c(Y-),则酸性HX>HY
D.若两溶液等体积混合,则c(Na+)=(a+b) mol/L(忽略混合过程中的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)![]() 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A. v(A)=0.15mol/(L·min) B. v (B)=0.6 mol/(L·min)
C. v (C)=0.3 mol/(L·min) D. v (D)=0.1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
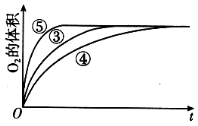
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________。
(2)实验①和②的目的是_____________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____________________。
(3)写出实验③的化学反应方程式:______________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象或操作预测的叙述正确的是
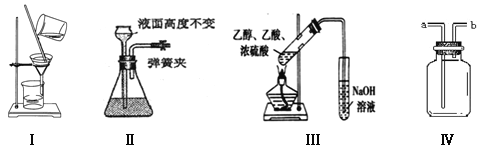
A.Ⅰ可用于分离乙醇和水
B.Ⅱ说明该装置气密性良好
C.Ⅲ该装置可用于制取并收集乙酸乙酯
D.Ⅳ由a进气可用于收集NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组拟用如图装置制备氮化钙(化学式为Ca3N2,极易与H2O反应),下列说法不正确的是 ( )

A. 打开活塞K通入N2,试管A内有气泡产生.说明装置气密性良好
B. 将产物Ca3N2放入盐酸中,能得到CaCl2和NH4Cl两种盐
C. U形管中盛放的干燥剂可以是碱石灰,但不能用浓硫酸
D. 反应结束后,先熄灭酒精灯,待反应管冷却至室温后再关闭活塞K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:
PCl5(g)=====PCl3(g)+Cl2(g) △H=akJ/mol(a>0)
0~10min保持容器温度不变,10min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。下列说法正确的是

A. 0~4min的平均速率v(Cl2)=0.05mol/(L·min )
B. 10min时改变的条件是分离出一定量的PCl5
C. 起始时向该容器中充入2.0mol PCl3和2.0molCl2,保持温度为T,反应达平衡时放出的热量大于1.6akJ
D. 温度为T,起始时向该容器中充入1.0mol PCl5、0.10mol PCl3和0.10molCl2,反应达到平衡前,v(正)>v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com