
【题目】已知2Fe2O3(s) +3C(s)=3CO2(g) +4Fe(s) △H=+468.2 kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
根据以上热化学方程式判断,下列说法正确的是 ( )
A. C(s)的燃烧热为393.5kJ
B. 右图可表示由C生成CO2的反应过程和能量关系
C. O2(g)与Fe(s)反应放出824.35kJ热量时,转移电子数为4NA
D. Fe2O3(s)+ ![]() C(g)=
C(g)= ![]() CO2(g)+2Fe(s) △H <234.1 kJ/mol
CO2(g)+2Fe(s) △H <234.1 kJ/mol
【答案】D
【解析】A. C(s)的燃烧热为393.5kJ/mol,故A错误;B. C生成CO2的反应需要加热条件以提高反应物的能量,右图不能表示由C生成CO2的反应过程和能量关系,故B错误;C. 将上述两个反应的热化学方程式相加减可得4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648.7kJ/mol,所以O2(g)与Fe(s)反应放出824.35kJ热量时,转移电子数为6NA,故C错误;D. 因为Fe2O3(s)+ ![]() C(s)=
C(s)= ![]() CO2(g)+2Fe(s) △H=+234.1kJ/mol C(s)=C(g) △H>0,所以Fe2O3(s)+
CO2(g)+2Fe(s) △H=+234.1kJ/mol C(s)=C(g) △H>0,所以Fe2O3(s)+ ![]() C(g)=
C(g)= ![]() CO2(g)+2Fe(s) △H <234.1 kJ/mol。故D正确。故选D。
CO2(g)+2Fe(s) △H <234.1 kJ/mol。故D正确。故选D。


科目:高中化学 来源: 题型:
【题目】(1)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH= 99 kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH= 99 kJ/mol。

请回答下列问题:
①图中A点表示: 。
C点表示: 。
E的大小对该反应的反应热 (填“有”或“无”)影响。
②图中ΔH = kJ/mol。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式: 。
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g)+![]() O2(g)
O2(g)![]() H2O( l )的ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
H2O( l )的ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)![]() 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A. v(A)=0.15mol/(L·min) B. v (B)=0.6 mol/(L·min)
C. v (C)=0.3 mol/(L·min) D. v (D)=0.1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 甲醛能作为肉类食品的保鲜剂
B. 植物油和矿物油均可用热的纯碱溶液洗涤
C. 淀粉和纤维素在人体内水解的最终产物均为葡萄糖
D. 《本草拾遗》记载“醋……消食,杀恶毒……”其中醋的主要成分是乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
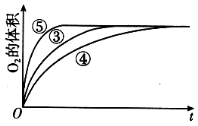
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________。
(2)实验①和②的目的是_____________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____________________。
(3)写出实验③的化学反应方程式:______________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象或操作预测的叙述正确的是
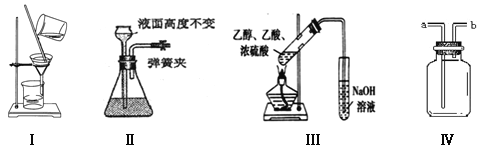
A.Ⅰ可用于分离乙醇和水
B.Ⅱ说明该装置气密性良好
C.Ⅲ该装置可用于制取并收集乙酸乙酯
D.Ⅳ由a进气可用于收集NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com