
| 3g |
| 2g/mol |
| 3g |
| 2g/mol |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
| 水质分类 项目及标准 | I类 | II类 | III类 | IV类 | V类 |
| 磷(P)≤ | 0.02 | 0.1 | 0.2 | 0.3 | 0.4 |
| 氮(N)≤ | 0.2 | 0.5 | 1.0 | 1.5 | 2.0 |
| 锌(Zn)≤ | 0.05 | 1.0 | 1.0 | 2.0 | 2.0 |
| 铅(Pb)≤ | 0.01 | 0.01 | 0.05 | 0.05 | 0.1 |
| pH | 6~9 | 6~9 | 6~9 | 6~9 | 6~9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 光和叶绿素 |
| hc |
| λ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 右图是元素周期表中的某一种元素的信息,下列有关该元素的信息不正确的是( )
右图是元素周期表中的某一种元素的信息,下列有关该元素的信息不正确的是( )| A、原子序数是 13 |
| B、它是非金属元素 |
C、离子结构示意图为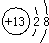 |
| D、相对原子质量是26.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、39gC2H2和C6H6混合物中含有的原子数为6NA |
| B、标准状况下,以任意比例混和的CO和C2H4混和物22.4L,所含有的原子数为2NA |
| C、23g甲酸中所含的共用电子对数为2.5NA |
| D、7.1gCl2与足量的NaOH溶液发生反应,电子转移数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com