
| A、39gC2H2和C6H6混合物中含有的原子数为6NA |
| B、标准状况下,以任意比例混和的CO和C2H4混和物22.4L,所含有的原子数为2NA |
| C、23g甲酸中所含的共用电子对数为2.5NA |
| D、7.1gCl2与足量的NaOH溶液发生反应,电子转移数为0.1 NA |
| m |
| M |
| m |
| M |
| m |
| M |
| 39g |
| 13g/mol |
| m |
| M |
| 23g |
| 46g/mol |
| m |
| M |
| 7.1g |
| 71g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| A、①④ | B、②④ | C、①③ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mole-均含有6.02×1023个 |
| B、若物质的质量在数值上等于该物质的相对分子质量,那么该物质就是1mol |
| C、1molCl2的质量是35.5g |
| D、SO3的摩尔质量是80g |
查看答案和解析>>
科目:高中化学 来源: 题型:
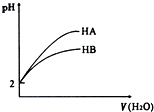 pH=2的两酸HA、HB加水稀释后,溶液pH随加水量的变化曲线如图所示.则下列叙述正确的是( )
pH=2的两酸HA、HB加水稀释后,溶液pH随加水量的变化曲线如图所示.则下列叙述正确的是( )| A、电离平衡常数HA>HB |
| B、等体积的HA和HB与等浓度的NaOH反应,HA消耗的NaOH多 |
| C、等体积的HA和HB与等质量的Zn反应,HA反应速率大 |
| D、另取0.1mol/L上面两酸HA、HB加水稀释100倍后,则酸性HB>HA |
查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
14 6 |
| A、只有②③⑤ |
| B、除④、⑤均正确 |
| C、只有①②③ |
| D、全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Br2+2Fe2+=2Fe3++2Br- |
| B、2Fe3++2I-=2Fe2++I2 |
| C、I2+2Fe2+=2Fe3++2I- |
| D、2Fe3++2Cl-=2Fe2++Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com