
【题目】在K2SO4和Fe2(SO4)3的混合溶液中,Fe3+的物质的量浓度为0.1molL﹣1 , SO42﹣的物质的量浓度为0.3molL﹣1 , 则混合液中K+的物质的量浓度为( )
A.0.15 molL﹣1
B.0.45 molL﹣1
C.0.3 molL﹣1
D.0.6 molL﹣1
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3、K2SO4和明矾的混合溶液中,如果c(SO42-)等于0.2mol/L,当加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,则原混合溶液中K+的物质的量浓度为
A.0.2mol/L B.0.25mol/L C.0.45mol/L D.0.225mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z在周期表中位置如图。下列说法正确的是( )
Z | |
X | Y |
A. 若它们均为金属元素,则X与氧元素组成的物质中一定只含离子键
B. 若它们的原子最外层电子数之和为11,则它们均为非金属元素
C. 它们的原子最外层电子数的大小顺序一定是Z=Y>X
D. Z的最高正化合价一定高于X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。下列关于该电池叙述错误的是( )
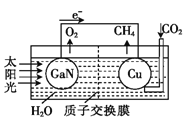
A.电池工作时,是将太阳能转化为电能
B. 铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO47H2O。
Ⅱ.将FeSO47H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用_____________。
(3)Ⅲ中,生成FeCO3的离子方程式是_____________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42-的操作是_____________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2![]() 2Fe2O3+4CO2。现煅烧464.0kg的FeCO3,得到316.8kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________kg。(摩尔质量/gmol-1:FeCO3116Fe2O3160FeO72)
2Fe2O3+4CO2。现煅烧464.0kg的FeCO3,得到316.8kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________kg。(摩尔质量/gmol-1:FeCO3116Fe2O3160FeO72)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.氧化还原反应的本质是元素化合价发生了变化
B.含化合价升高元素的反应物被氧化
C.得到电子的物质被氧化
D.氧化还原反应中,氧化剂和还原剂一定是两种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:3CH4(g) + 2N2(g)![]() 3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如下图所示:
3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如下图所示:

下列说法正确的是
A.n(CH4)/n(N2)越大,CH4的转化率越高
B.n(CH4)/n(N2)不变时,若升温,NH3的体积分数会增大
C.b点对应的平衡常数比a点的大
D.a点对应的NH3的体积分数约为26%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.NaCl固体可导电
B.NaHSO4溶于水电离出H+,则NaHSO4属于酸
C.HCl溶于水能导电,但液态HCl不能导电
D.导电能力强的溶液里能够自由移动的离子数目一定比导电能力弱的溶液里能够自由移动的离子数目多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com