
【题目】短周期主族元素X、Y、Z在周期表中位置如图。下列说法正确的是( )
Z | |
X | Y |
A. 若它们均为金属元素,则X与氧元素组成的物质中一定只含离子键
B. 若它们的原子最外层电子数之和为11,则它们均为非金属元素
C. 它们的原子最外层电子数的大小顺序一定是Z=Y>X
D. Z的最高正化合价一定高于X
科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是

选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | Na2O2 | NaOH | NaCl | ①常温遇水 |
B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
C | NO | NO2 | HNO3 | ④加入铜粉 |
D | Cl2 | NaClO | HClO | ③加浓盐酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用下图所示电解装置吸收和转化SO2(A、B均为惰性电极)。下列说法正确的是
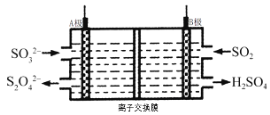
A.A电极接电源的正极
B.A极区溶液的碱性逐渐增强
C.本装置中使用的是阴离子交换膜
D.B极的电极反应式为SO2+2e-+2H2O = SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.体积相同、浓度均为0.1 mol·L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n
B.有甲、乙两氨水溶液,测得甲的pH=a,乙的pH=a+1,则甲乙两溶液c(H+)之比为10:1
C.相同温度下,0.2 mol·L-1乙酸溶液与0.1 mol·L-1乙酸溶液中c(H+)之比为2∶1
D.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,K=![]() 。若加入少量醋酸钠固体,则CH3COOHCH3COO-+H+向左移动,α减小,K变小
。若加入少量醋酸钠固体,则CH3COOHCH3COO-+H+向左移动,α减小,K变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在K2SO4和Fe2(SO4)3的混合溶液中,Fe3+的物质的量浓度为0.1molL﹣1 , SO42﹣的物质的量浓度为0.3molL﹣1 , 则混合液中K+的物质的量浓度为( )
A.0.15 molL﹣1
B.0.45 molL﹣1
C.0.3 molL﹣1
D.0.6 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KCl、MgCl2、MgSO4形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(SO42-)为
A.0.15mol/L B.0.20mol/L C.0.25mol/L D.0.40mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁、氧化铝的熔点高,常作耐高温材料。以MgC12和AlCl3的混合液为主要原料,设计实验制备氧化镁、氧化铝。实验步骤如下:
Ⅰ.取混合液于烧杯中,加入过量的氢氧化钠溶液,充分搅拌,静置;
Ⅱ.过滤得到沉淀和滤液;洗涤、灼烧,得到固体X;
Ⅲ.在步骤Ⅱ所得滤液中加人足量盐酸,再滴加过量的浓氨水;
Ⅳ.过滤、洗涤、灼烧,得到固体Y 。
(1)固体X的名称是_______。
(2)写出步骤Ⅰ中的离子反应方程式:________;________。
(3)步骤Ⅱ过滤中使用的三种玻璃仪器分别为烧杯、漏斗、______。
(4)步骤Ⅲ中,能否使用氢氧化钠溶液替代浓氨水_____(填“能”或“否”)。
(5)写出步骤Ⅳ中“灼烧”发生的化学反应方程式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com