
 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度/(mol•L-1) | 2 | 1 | 2 | 1 |
| A. | Mg2+ | B. | Ba2+ | C. | F- | D. | Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
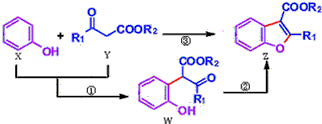
| A. | 反应①属于加成反应 | B. | W中含有三种不同的官能团 | ||
| C. | X、Y、W、Z都能与NaHCO3溶液反应 | D. | 可用溴水或FeCl3溶液鉴别X和W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
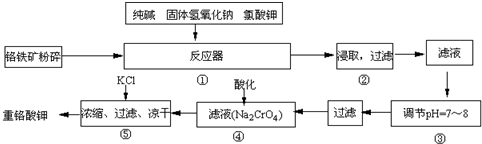
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当4v(H2)=v(N2)时,反应达到平衡 | |
| B. | 升高温度,正反应速率减小,逆反应速率增大 | |
| C. | 使用高效催化剂可提高NO的平衡转化率 | |
| D. | 化学平衡常数表达式为K=$\frac{c({N}_{2})×{c}^{4}({H}_{2}O)}{c(S{O}_{2})×{c}^{2}(NO)×{c}^{4}({H}_{2})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 盐酸 | B. | 氯化铵水溶液 | C. | 硝酸钠水溶液 | D. | 氢氧化钠水溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com