
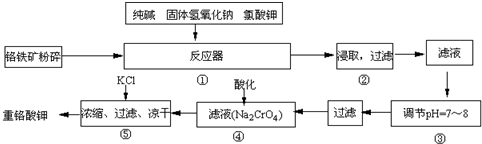
分析 由流程可知,铬铁矿(主要成分为FeO•Cr2O3,杂质为SiO2、Al2O3)为原料粉碎后再反应器中加入纯碱、固体氢氧化钠、氯酸钾浸取过滤得到滤液调节溶液PH除去铝和硅酸根离子,过滤得到Na2CrO4溶液,酸化后加入氯化钾浓缩过滤干燥得到重铬酸钾;
(1)氧化铝和碳酸钠反应生成偏铝酸钠和二氧化碳;
(2)NaFeO2能强烈水解,生成氢氧化铁沉淀;
(3)③调节后溶液的pH比原来降低,是因降低pH,促进水解平衡正向移动;
(4)CrO42-和酸反应生成Cr2O72-和水;
(5)①达到滴定终点时颜色突变且30s不变色;
②由Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 可知,存在Cr2O72-~6S2O32-,以此计算.
解答 解:(1)氧化铝和碳酸钠反应生成偏铝酸钠和二氧化碳,反应方程式为:Al2O3+Na2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaAlO2+CO2↑,
故答案为:Al2O3+Na2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaAlO2+CO2↑;
(2)NaFeO2能强烈水解,生成氢氧化铁沉淀,该水解反应为NaFeO2+2H2O=Fe(OH)3↓+NaOH,
故答案为:NaFeO2+2H2O=Fe(OH)3↓+NaOH;
(3)③调节后溶液的pH比原来降低,是由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,
故答案为:由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,除去SiO32-和AlO2-;
(4)CrO42-和酸反应生成Cr2O72-和水,转化方程式为:2CrO42-+2H+?Cr2O72-+H2O,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;
(5)①达到滴定终点时,当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化,
故答案为:当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化;
②由Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 可知,
存在Cr2O72-~6S2O32-,
1 6
n 0.1200mol/L×0.040L
n=0.0008mol
250ml溶液中含有Cr2O72-物质的量为0.0008mol×$\frac{250}{25}$=0.008mol;
所得产品中重铬酸钾纯度=$\frac{0.008mol×294g/mol}{2.500g}$×100%=94.08%,
故答案为:94.08%.
点评 本题考查混合物的分离、提纯,明确流程中操作的目的是解答的关键,注意利用关系式计算,(5)为解答的难点,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞. ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成淡黄色沉淀 |
| 实验方案 | 实验现象 | 有关离子方程式 |
| A | ||
| B | 不填 | |
| C | 不填 | |
| D | 不填 | |
| E |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
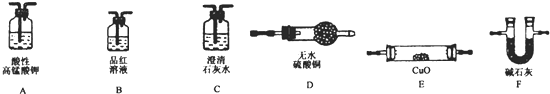
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| M(OH)n | Ksp | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 Na2SO3溶液加水稀释,c(H+):c(SO32-)的值逐渐减小 | |
| B. | pH为6的碳酸溶液,水电离出的c(H+)=1.0×10-6mol•L-1 | |
| C. | pH为12的氢氧化钡溶液与pH为2的盐酸溶液等体积混合,溶液呈碱性 | |
| D. | 把0.2mol•L-1醋酸与0.1mol•L-1醋酸钠溶液等体积混合c(CH3COOH)+c(CH3COO-)=3c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=1 | |
| B. | A的平均反应速率为0.3mol/(L•s) | |
| C. | B的转化率为60% | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H6 | B. | C3H6 | C. | C3H8 | D. | C5H8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com