

���� �����к�ˮɹ�εõ����Σ������ᴿ�õ����Σ������ܽ��õ�����ʳ��ˮ����ⱥ��ʳ��ˮ�����������ơ��������������ȼҵ�������Ȼ�����Һ������ͨ�백����������̼������̼�����ƾ�����Ȼ�泥��õ�̼���������ȷֽ�����̼���ƣ���������Ϊ��°��Ƽ��
��1�������е�ⱥ��ʳ��ˮ���ȼҵ�������Ȼ�����Һ������ͨ�백����������̼������̼�����ƾ���Ϊ��°��Ƽ��
��2������þ���ӻ������������Ӻ�̼����������ɳ����������ӻ���̼����������ɳ�������������ӻ��뱵�������ɳ���������������Գ�ȥ������̼���ƺ��������ƵȽ��з�����
��3�����ݵ��ԭ�������жϲ�����д���ӷ���ʽ���������������ӵõ����ӷ�����ԭ��Ӧ�������Ӻ������ӵ����ӽṹ�����Ӱ뾶�������õ����ӵ�������
��4�����̢����ڱ��͵��Ȼ�����Һ����ͨ�백������ͨ�������̼����̼�����ƾ�����Ȼ�泥�������̼�����Ƶ��ܽ����С��
��5��������Һ�еõ����ʾ���ķ�����ͨ������Ũ������ȴ�ᾧ������ϴ�ӣ��ظ����νᾧ����Ϊ�ؽᾧ����Ӧ�������Ȼ�ѧ����ʽ��˹���ɼ���õ���
��� �⣺��1�������к�ˮɹ�εõ����Σ������ᴿ�õ����Σ������ܽ��õ�����ʳ��ˮ����ⱥ��ʳ��ˮ�����������ơ��������������ȼҵ�������Ȼ�����Һ������ͨ�백����������̼������̼�����ƾ�����Ȼ�泥���������Ϊ��°��Ƽ���������Ƽ
�ʴ�Ϊ���ȼҵ�������Ƽ
��2�����˿��Գ�ȥ���ɵij�������ɳ������������������ƿ��Գ�ȥþ���ӣ������Ȼ������Գ�ȥ��������ӣ�����������̼���ƿ��Գ�ȥ�����Ӻͷ�Ӧʣ����Ȼ���������������������Գ�ȥ��Ӧʣ����������ƺ�̼���ƣ�
a��Na2CO3��NaOH��BaCl2��Һ��˳���б����Ӳ��ܳ�ȥ����a����
b��NaOH��BaCl2��Na2CO3��Һ��˳����Գ�ȥ�������ӣ���b��ȷ��
c��NaOH��Na2CO3��BaCl2��Һ��˳���ܳ�ȥ�����ӣ���c����
d��BaCl2��Na2CO3��NaOH��Һ��˳����Գ�ȥ�������Ӳ������µ����ʣ���d��ȷ��
��ѡbd��
�ʴ�Ϊ��bd��
��3����ⱥ��ʳ��ˮ��������������ʧ���ӷ���������Ӧ���������������������ӵõ����ӷ�����ԭ��Ӧ�����������缫����ˮ�ĵ���ƽ��������У���Һ������������Ũ��������Һ�Լ��ԣ���ҺPH����ⱥ��NaCl��Һ�����ӷ���ʽΪ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH-+H2��+Cl2����
�ʴ�Ϊ��Cl2������
��4�����ݷ�Ӧԭ����֪�����Ȼ�����Һ����ͨ�백����Ϊ�����������̼�ķ�Ӧ��������̼�����ƾ�����������Ӧ�Ļ�ѧ����ʽΪ��NaCl+CO2 +NH3+H2O=NaHCO3��+NH4Cl��NaCl��NH4Cl��NaHCO3��NH4HCO3 ��Ӧ��֪��̼��������ͬ�¶�����С������dΪ̼�����ƣ�
�ʴ�Ϊ��d��NaCl+CO2 +NH3+H2O=NaHCO3��+NH4Cl��
��4���ٽ�̼������Ʒ������ˮ�ܽ⣬ͨ������Ũ������ȴ�ᾧ���������˵õ����壬�ظ����νᾧ�����ᴿ�����̢��У����ô�������������������ʣ����õ��ᴿ�������ؽᾧ��Na2CO3•H2O��s��=Na2CO3��s��+H2O��g����H1=+58.73kJ•mol-1 ��1��
Na2CO3•10H2O��s��=Na2CO3•H2O��s��+9H2O��g����H1=+473.63kJ•mol-1 ��2��
��1��+��2���õ�Na2CO3•10H2O��s��=Na2CO3��s��+10H2O��g����H3=+532.36kJ•mol-1
��������������Ч��ʧ��������������1molNa2CO3ֻ�����92.36kJ��
����ˮ�仯ΪҺ��ʱ����532.36KJ-92.36KJ=440KJ��10H2O��g��=10H2O��l����H4=-440KJ/mol
H2O��g��=H2O��l����H=-44.0KJ/mol��
�ʴ�Ϊ���ؽᾧ��-44.0KJ/mol��
���� ���⿼���˻��������ʵ�鷽�����Լ�ѡ��ҵ�Ʊ���������̷����жϣ���˹���ɼ���Ӧ�ã�ע����ӵ�����������������ʣ�����Ҫ�������г�������������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.3 mol/L | B�� | 0.4 mol/L | C�� | 0.5 mol/L | D�� | 0.6 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
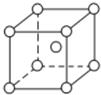 ��֪A��B��C��D��E�������ڱ���ǰ������ԭ���������������Ԫ�أ�����A��B��C��ͬһ���ڵķǽ���Ԫ�أ�D��C�����γ����ֳ��������Ӿ��壬D����������C�������Ӿ�����ͬ�ĵ��Ӳ�ṹ��AC2Ϊ�Ǽ��Է��ӣ�B��C���⻯��ķе������ͬ����������Ԫ���⻯��ķе�ߣ�E��ԭ������Ϊ24��ECl3����B��C���⻯���γ�����λ�������M����������������ʵ���֮��Ϊ2��1������������λ����磮���������������ش��������⣺������ʱ��A��B��C��D��E������Ӧ��Ԫ�ط��ű�ʾ��
��֪A��B��C��D��E�������ڱ���ǰ������ԭ���������������Ԫ�أ�����A��B��C��ͬһ���ڵķǽ���Ԫ�أ�D��C�����γ����ֳ��������Ӿ��壬D����������C�������Ӿ�����ͬ�ĵ��Ӳ�ṹ��AC2Ϊ�Ǽ��Է��ӣ�B��C���⻯��ķе������ͬ����������Ԫ���⻯��ķе�ߣ�E��ԭ������Ϊ24��ECl3����B��C���⻯���γ�����λ�������M����������������ʵ���֮��Ϊ2��1������������λ����磮���������������ش��������⣺������ʱ��A��B��C��D��E������Ӧ��Ԫ�ط��ű�ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SiO2��Ħ��������60 | |
| B�� | 1mol SiO2���1mol O2 | |
| C�� | 1.5mol SiO2�к���1.806��1024����ԭ�� | |
| D�� | 1mol SiO2��������60g•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaAl��SO4��2��Һ�еμ�Ba��OH��2ֱ��SO42-������ȫ��2Al3++6OH-+3SO42-+3Ba2+=2Al��OH��3��+3BaSO4�� | |
| B�� | NH4HS��Һ��������NaOH��Һ��Ӧ��NH4++OH-=NH3•H2O | |
| C�� | ϡH2SO4��Na2S2O3��Һ���ȣ�S2O32-+2H+$\frac{\underline{\;\;��\;\;}}{\;}$SO2��+S��+H2O | |
| D�� | ����Cl2ͨ��Fel2��Һ�У�3Cl2+2I-+4Fe2+=4Cl-+I2+4Fe3+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | С��2��7 | B�� | ����2��7 | C�� | ����2��7 | D�� | ���϶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ֻ�Т� | B�� | ֻ�Т٢� | C�� | ֻ�Тڢ� | D�� | �٢ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com