
| A. | 只有① | B. | 只有①② | C. | 只有②③ | D. | ①②③④ |
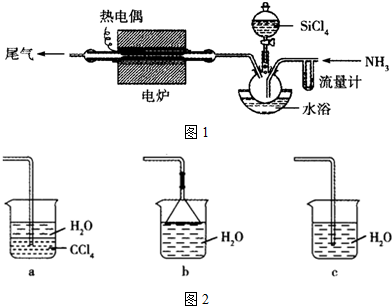
分析 SiCl4的分子结构与CCl4类似,与CCl4根据的结构和性质分析,CCl4属于分子晶体,常温为液体,含有共价键,分子晶体的相对分子质量越大,沸点越高,据此分析.
解答 解:SiCl4的分子结构与CCl4类似,与CCl4根据的结构和性质分析,CCl4属于分子晶体,常温为液体,含有共价键,分子晶体的相对分子质量越大,熔点越高,
①CCl4结构价层电子对数为4,没有孤对电子对,故空间结构为正四面体结构,SiCl4与CCl4结构相似,也为正四面体,故正确;
②SiCl4与CCl4结构相似,常温常压下SiCl4是液体,故正确;
③SiCl4中Si与Cl形成共价键,则SiCl4是由极性共价键形成的分子,故正确;
④分子晶体的相对分子质量越大,熔点越高,则SiCl4熔点高于CCl4,故正确;
所以正确的有①②③④;
故选D.
点评 本题考查了物质的结构和性质,采用类比法分析,题目难度不大,注意把握CCl4的结构和性质.


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=1 | |
| B. | A的平均反应速率为0.3mol/(L•s) | |
| C. | B的转化率为60% | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | y=1×a% | B. | y=1-1×a% | C. | y=1×a%=0.5 | D. | y=1-1×a%<0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
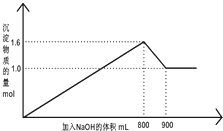 向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:
向1L A1Cl3和FeCl3的混合溶液,逐滴加入NaOH 的溶液.产生沉淀的物质的量和加入溶液的体积的关系如图所示,回答下列问题:| 溶质 | A1Cl3 | FeCl3 |
| 物质的量浓度 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④⑤ | C. | ①②③④⑤ | D. | 只有⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.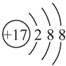 .
.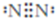 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com