
分析 (1)硫酸的酸性强于碳酸,应用强酸制弱酸;
(2)浓硫酸的吸水性,干燥H2、SO2等气体;
(3)铝与浓硫酸发生钝化,用铝槽车装运浓硫酸;
(4)清洗镀件表面氧化物与硫酸发生复分解反应,体现硫酸的强酸性;
(5)浓硫酸使湿润石蕊试纸变红,体现硫酸的酸性,后来又变黑,体现脱水性.
解答 解:(1)硫酸的酸性强于碳酸,应用强酸制弱酸,所以硫酸的强酸性,故选:A;
(2)浓硫酸的吸水性,干燥H2、SO2等气体,故选:C;
(3)铝与浓硫酸发生钝化,用铝槽车装运浓硫酸,体现硫酸的强氧化性,故选:E;
(4)清洗镀件表面氧化物与硫酸发生复分解反应,体现硫酸的强酸性,故选:A;
(5)浓硫酸使湿润石蕊试纸变红,体现硫酸的酸性,后来又变黑,体现脱水性,所以既体现强酸性又体现强氧化性,故选:AD.
点评 本题考查浓硫酸的性质,熟悉浓硫酸有吸水性、脱水性、强氧化性是解答的关键,明确钝化发生氧化还原反应,题目难度不大.


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:多选题
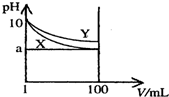 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | Y碱溶液稀释过程中溶液中c(H+)减小 | |
| B. | 稀释后,X溶液的碱性比Y溶液的碱性弱 | |
| C. | 分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积VX>VY | |
| D. | 若8<a<10,则X、Y都是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol/L | B. | 0.4 mol/L | C. | 0.5 mol/L | D. | 0.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
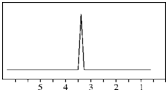 (1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)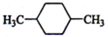 B、
B、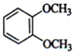 C、
C、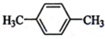 D、CH3CH2CH2CH3
D、CH3CH2CH2CH3查看答案和解析>>
科目:高中化学 来源: 题型:解答题
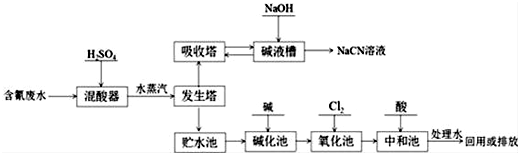
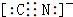 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
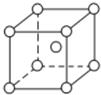 已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2的摩尔质量是60 | |
| B. | 1mol SiO2中含有1mol O2 | |
| C. | 1.5mol SiO2中含有1.806×1024个氧原子 | |
| D. | 1mol SiO2的质量是60g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有①② | C. | 只有②③ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com