
 (1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)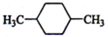 B、
B、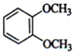 C、
C、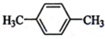 D、CH3CH2CH2CH3
D、CH3CH2CH2CH3分析 (1)核磁共振氢谱中给出的峰值(信号)有2个,说明有2种H原子,且峰的面积比为3:2的,即H原子个数为3:2;
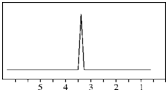
(2)化合物A的分子式是C2H4Br2,A的核磁共振氢谱图如图,说明结构对称,含有1种H;
(3)C4H8可为烯烃和环烷烃;
(4)某化合物A 3.1g在氧气中完全燃烧,只生成4.4gCO2和2.7gH2O.可计算C、H的质量并确定O的质量,进而计算C、H、O的原子个数比,计算最简式,结合结构特点确定有机物结构简式.
解答 解:(1)核磁共振氢谱中给出的峰值(信号)有2个,说明有2种H原子,且峰的面积比为3:2的,即H原子个数为3:2,符合要求的有CD,A有2种H,但比值为3:4,B有3种H,故答案为:CD;
(2)化合物A的分子式是C2H4Br2,A的核磁共振氢谱图如图,说明结构对称,含有1种H,应为Br-CH2-CH2-Br,故答案为:Br-CH2-CH2-Br;
(3)C4H8且属于烯烃的有机物结构有:CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2,其中CH3CH=CHCH3存在顺反异构,共4种,另有环丁烷、甲基环丙烷,共6种,
故答案为:6;
(4)某化合物A 3.1g在氧气中完全燃烧,只生成4.4gCO2和2.7gH2O.可知n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,m(C)=1.2g,m(H)=0.3g,则m(O)=3.1g-1.2g-0.3g=1.6g,n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,则N(C):N(H):N(O)=0.1:0.3:0.1=1:3:1,则A的最简式为CH3O,A的红外光谱表明有羟基O-H键和烃基上C-H键的红外吸收峰,而A在核磁共振氢谱中出现两组峰,且其面积之比为2:1,则该有机物的简式为HO-CH2-CH2-OH,
故答案为:CH3O;HO-CH2-CH2-OH.
点评 本题综合考查有机物的推断,侧重于学生的分析、计算能力的考查,题目难度不大,本题注意根据有机物生成的二氧化碳和水的质量结合相对分子质量可判断有机物的分子式,注意有机物的结构特点.


科目:高中化学 来源: 题型:解答题
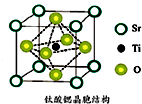 氢能被视作连接化石能源和可再生能源的重要桥梁.
氢能被视作连接化石能源和可再生能源的重要桥梁.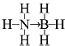 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞. ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成淡黄色沉淀 |
| 实验方案 | 实验现象 | 有关离子方程式 |
| A | ||
| B | 不填 | |
| C | 不填 | |
| D | 不填 | |
| E |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2中所含阴离子的数目是0.2NA | |
| B. | 标准状况下,22.4 L SO3含分子数为NA | |
| C. | 标准状况下,2.24 L 18O2中所含中子的数目是2NA | |
| D. | 用足量NaOH溶液完全吸收1 mol Cl2时,转移电子的数目是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
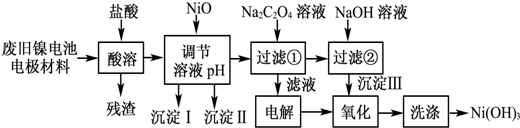
| M(OH)n | Ksp | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=1 | |
| B. | A的平均反应速率为0.3mol/(L•s) | |
| C. | B的转化率为60% | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com