
 氢能被视作连接化石能源和可再生能源的重要桥梁.
氢能被视作连接化石能源和可再生能源的重要桥梁.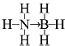 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式). 分析 (1)a.结构不对称,属于极性分子,反之为非极性分子;
b.根据杂化轨道理论分析水分子空间构型;
c.根据价电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数;
d.配合物也叫络合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成,CuSO4•5H2O晶体中4个水分子是作为配体配位在铜离子上;
(2)利用均摊法计算该晶胞中含有的原子个数,从而确定其化学式;
(3)①Ni是28号元素,根据能量最低原则、泡利不相容原理和洪特规则,写出其核外电子排布式,据此判断其所在位置;
②根据氮原子提供一对共用电子对给硼原子形成配位键;根据等电子体具有相同的电子数目和原子数目来分析.
解答 解:(1)a.H2O中H、O元素形成的极性键,但结构不对称,属于极性分子,故a正确;
b.水分子中氧原子含有2个σ键且含有两个孤电子对,所以采用sp3杂化,空间结构呈V型,故b正确;
c.H2O分子中2个氢原子的2个由s轨道与氧原子的sp3杂化轨道形成σ键,故c正确;
d.CuSO4•5H2O加热到113℃时,只失去4分子水.只有加热到258℃以上,才能脱去最后一分子水.由此可见,4个水分子是作为配体配位在铜离子上的,故d错误;
故选:abc;
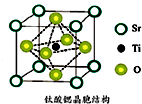
(2)该晶胞中Ti原子个数为1,O原子个数6×$\frac{1}{2}$=3,Sr原子的个数为8×$\frac{1}{8}$=1,所以化学式为SrTiO3,
故答案为:SrTiO3;
(3)①Ni是28号元素,其核外电子排布式为:1s22s22p43s23p43d84s2,最大主量子数为4,位于元素周期表第10列,其在元素周期表位置为:第四周期第Ⅷ族,
故答案为:1s22s22p63s23p63d84s2(或[Ar]3d84s2);第四周期、Ⅷ族;
②氮原子提供一对共用电子对给硼原子形成配位键,氨硼烷的结构式为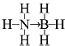 ,等电子体具有相同的电子数目和原子数目,与氨硼烷互为等电子体的有机小分子是CH3CH3,
,等电子体具有相同的电子数目和原子数目,与氨硼烷互为等电子体的有机小分子是CH3CH3,
故答案为: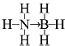 ;CH3CH3.
;CH3CH3.
点评 本题主要考查了分子晶体、晶胞结构、核外电子排布等知识,综合性较强,难度中等,解题时要注意晶体结构的有关知识的灵活运用.


科目:高中化学 来源: 题型:填空题
 CH3COOCH2CH3+H2O已知:乙醛可氧化为乙酸(该方程式不用写)
CH3COOCH2CH3+H2O已知:乙醛可氧化为乙酸(该方程式不用写)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量CH3COONa固体 | B. | 加水 | ||
| C. | 加少量CuSO4固体 | D. | 加等量等浓度Na2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 工业粉尘中含有Pb、Cd、Cr、V、As等金属元素,过量摄入均对人体有害 | |
| C. | 用工业明胶制作用药胶囊,会导致过量Cr元素摄入人体而提高致癌风险 | |
| D. | 分光光度计通过测定溶液颜色分析反应物(或生成物)浓度变化,从而确定化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
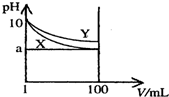 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | Y碱溶液稀释过程中溶液中c(H+)减小 | |
| B. | 稀释后,X溶液的碱性比Y溶液的碱性弱 | |
| C. | 分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积VX>VY | |
| D. | 若8<a<10,则X、Y都是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应实质是旧键断裂新键形成,化学反应中的能量变化本质原因就是旧键断裂所吸收的能量和新键形成所释放的能量不同 | |
| B. | 极性键就是共用电子对发生偏移的共价键 | |
| C. | 氢键是一种比较弱的化学键 | |
| D. | 水结冰时体积膨胀、密度减小就是因为氢键的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
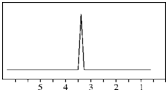 (1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)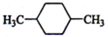 B、
B、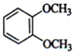 C、
C、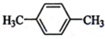 D、CH3CH2CH2CH3
D、CH3CH2CH2CH3查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com