
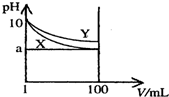
 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | Y碱溶液稀释过程中溶液中c(H+)减小 | |
| B. | 稀释后,X溶液的碱性比Y溶液的碱性弱 | |
| C. | 分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积VX>VY | |
| D. | 若8<a<10,则X、Y都是弱碱 |
分析 根据信息可知开始时两种碱溶液具有相同的体积和pH,而加水稀释时,X溶液的pH下降较快,故X溶液的碱性强于Y,而碱性越强,溶液的浓度越小,据此分析.
解答 解:A、Y碱溶液在稀释过程中,溶液中的c(OH-)减小,而根据水的离子积Kw=c(H+)•c(OH-)不变可知,c(H+)会增大,故A错误;
B、稀释后,X溶液的pH小于Y溶液,故X溶液的碱性更弱,故B正确;
C、开始时两种碱溶液具有相同的体积和pH,而加水稀释时,X溶液的pH下降较快,故X溶液的碱性强于Y,而碱性越强,溶液的浓度需越小,即X溶液的浓度小于Y溶液,即X的物质的量小于Y,但由于碱的元数未知,故消耗等浓度的盐酸的体积的大小无法确定,故C错误;
D、若为强碱,根据强碱的稀释定律可知,稀释后溶液的pH应变为8,故当8<a<10,则X、Y都是弱碱,故D正确.
故选BD.
点评 本题考查了碱的稀释对溶液的pH的影响,应注意的是pH变化大的碱性更强,则溶液的浓度更小,本题综合性较强,难度不大.


科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 观察钠与水反应的现象 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 检验NaHCO3与Na2CO3溶液 | 用小试管分别取少量溶液,然后滴加澄清石灰水 |
| C | 证明Na2O2与CO2是放热反应 | Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应 |
| D | 检验Na2CO3与K2CO3溶液 | 用稀硫酸清洗过的铂丝分别蘸取溶液,在酒精灯外焰上灼烧,透过蓝色钴玻璃观察火焰的颜色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
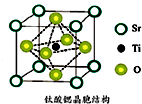 氢能被视作连接化石能源和可再生能源的重要桥梁.
氢能被视作连接化石能源和可再生能源的重要桥梁.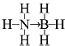 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:8 | B. | 2:5 | C. | 5:2 | D. | 5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 85% | C. | 90% | D. | 95% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com