
| A. | 0.1mol•L-1 Na2SO3溶液加水稀释,c(H+):c(SO32-)的值逐渐减小 | |
| B. | pH为6的碳酸溶液,水电离出的c(H+)=1.0×10-6mol•L-1 | |
| C. | pH为12的氢氧化钡溶液与pH为2的盐酸溶液等体积混合,溶液呈碱性 | |
| D. | 把0.2mol•L-1醋酸与0.1mol•L-1醋酸钠溶液等体积混合c(CH3COOH)+c(CH3COO-)=3c(Na+) |
分析 A.Na2SO3溶液水解呈碱性,加水稀释,c(H+)增大,c(SO32-)减小;
B.碳酸溶液抑制水的电离,溶液中氢氧根离子是水电离的;
C.两溶液恰好反应,反应后溶液呈中性;
D.根据混合液中的物料守恒分析.
解答 解:A.Na2SO3溶液水解呈碱性,加水稀释后溶液中c(H+)增大,而c(SO32-)减小,c(H+):c(SO32-)的值逐渐增大,故A错误;
B.碳酸溶液抑制水的电离,水电离出的c(OH-)=1.0×10-8 mol•L-1,所以水电离出的c(H+)=1.0×10-8mol•L-1,故B错误;
C.氢氧化钡为强碱,盐酸为强酸,所以pH为12的氢氧化钡溶液与pH为2的盐酸溶液等体积混合,溶液呈中性,故C错误;
D.根据混合液中的物料守恒可得:c(CH3COOH)+c(CH3COO-)=3c(Na+),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、物料守恒的含义为解答关键,B为易错点,注意酸碱溶液抑制了水的电离,能够水解的盐溶液促进了水的电离.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 电解Na2SO4饱和溶液,若生成2 NA个H2,一定生成NA个O2 | |
| C. | 常温常压下,46 g NO2的原子数为3NA | |
| D. | 1 mol NO,与H2O完全反应时转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
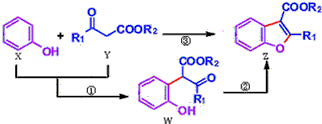
| A. | 反应①属于加成反应 | B. | W中含有三种不同的官能团 | ||
| C. | X、Y、W、Z都能与NaHCO3溶液反应 | D. | 可用溴水或FeCl3溶液鉴别X和W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于2:7 | B. | 等于2:7 | C. | 大于2:7 | D. | 无法肯定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当4v(H2)=v(N2)时,反应达到平衡 | |
| B. | 升高温度,正反应速率减小,逆反应速率增大 | |
| C. | 使用高效催化剂可提高NO的平衡转化率 | |
| D. | 化学平衡常数表达式为K=$\frac{c({N}_{2})×{c}^{4}({H}_{2}O)}{c(S{O}_{2})×{c}^{2}(NO)×{c}^{4}({H}_{2})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键 | B. | 共价键 | C. | 配位键 | D. | 范德华力 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com