
【题目】下列说法正确的是
A. 溶液焰色反应时,如果火焰呈黄色就说明该溶液一定有钠元素,一定没有钾元素
B. 除去CO2中的HCl气体,只需将气体通过NaOH溶液
C. 在某溶液中滴加硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中一定含SO![]()
D. 在氧化还原反应中,阳离子也能失去电子被氧化,阴离子也能得到电子被还原
【答案】D
【解析】A项,某溶液焰色反应时,如果火焰呈黄色说明该溶液中一定有钠元素,可能有钾元素,钾元素焰色反应需要透过蓝色钴玻璃观察呈紫色,不隔着钴玻璃呈黄色不能判断钾元素是否存在,故A错误;B项,CO2和HCl气体都能与NaOH溶液反应,除去CO2中的HCl气体,不能用NaOH溶液,应将混合气体通过饱和NaHCO3溶液,故B错误;C项,白色沉淀也可能是AgCl,此种情况溶液中没有SO42-,而有Ag+,还可能溶液中有SO32-,滴加硝酸将其氧化成SO42-而产生了BaSO4沉淀,故C错误;D项,阳离子如果处于中间价态,可以被氧化,如Fe2+可被氧化成Fe3+,阴离子如具有强氧化性,可得电子被还原,如NO3-、MnO4-等,故D正确。


科目:高中化学 来源: 题型:
【题目】工业上从海水中提取溴的主要反应是:C12+2Br-=2Cl-+Br2 。下列说法错误的是
A. 海水中溴元素主要以形式Br-存在B. 上述反应属于离子反应
C. 该反应中氧化剂是Br-D. 上述反应属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJ/mol.现将1molN2(g)、3molH2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分数为φ,下列说法中正确的是( ) 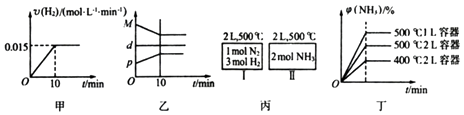
A.若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示
B.反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C.如图丙所示,容器I和II达到平衡时,NH3的体积分数为φ,则容器I放出热量与容器II吸收热量之和为92.4kJ
D.若起始加入物料为1 mol N2 , 3 mol H2 , 在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)主要用于制革、印染、电镀等.其水溶液中存在平衡:Cr2O72﹣+H2O2CrO42﹣+2H+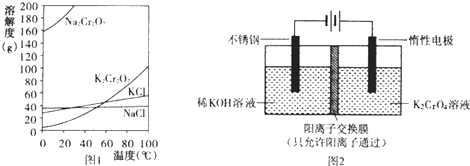
(1)已知有关物质溶解度如图1.用复分解法制备K2Cr2O7的操作过程是:向Na2Cr2O7溶液中加入(填化学式),搅拌溶解,调节溶液pH约为5,加热溶液至表面有少量晶体析出时, , 抽滤得到粗产品,再用重结晶法提纯粗产品.
(2)以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图2.
①不锈钢作极,写出该电极的电极反应式 .
②分析阳极区能得到重铬酸钾溶液的原因 .
③当铬酸钾的转化率达到x时,阳极液中K与Cr的物质的量之比为
(3)铬对环境能造成污染.某酸性废水中含有Cr2O72﹣ , 处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72﹣转化为毒性较低的Cr3+ , 再调节pH约为8,使铬元素沉降,分离出污泥后检测废水中Cr3+浓度,低于0.5mgL﹣1则达到排放标准.
①Na2S2O5参加反应的离子方程式为 .
②经上述工艺处理后的废水,理论上Cr3+浓度约为 mgL﹣1 .
(已知室温下Ksp[Cr(OH)3]≈6×10﹣31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是造纸、玻璃、纺织、制革等行业的重要原料.
(1)路布兰法制备纯碱:①食盐与硫酸反应生成硫酸钠;②将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成.第②步反应的化学方程式为 .
(2)①原盐水中含少量Mg2和Ca2 , 结合生产实际,精制盐水需要的试剂时、 . (填化学式)
②步骤 II保持在30﹣35℃进行,反应的化学方程式为 , 该反应能发生的原因是 . 该工艺中循环利用的物质是 .
③索尔维制纯碱不需要用到的一种设备是 (填正确答案标号).
A.吸氨塔 B.蒸氨塔 C.碳酸化塔 D.沸腾炉 E.石灰窑
④该工艺中食盐利用率大约只有70%,食盐损失的主要原因是 . 我国科学家侯德榜将合成氨工业得到的NH3和CO2引入纯碱的生产,向上述工艺的“母液”中通入NH3并加入食盐固体,降温结晶得到副产品(填化学式),剩余母液返回“吸氨”步骤,大大提高了食盐的利用率.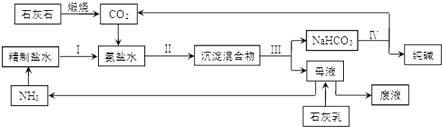
(3)纯碱产品中可能含有碳酸氢钠.用热重分析的方法测定纯碱中碳酸氢钠的质量分数为ω(NAHCO3)=(列出算式,所需数据用字母表示,并说明各字母的含义).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2C(s)+O2(g)═2CO(g)△H=﹣221.0kJmol﹣1;
②2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1 .
则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
A.262.6 kJmol﹣1
B.﹣131.3 kJmol﹣1
C.﹣352.3 kJmol﹣1
D.131.3 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:W、Y、Z、T、M为前四周期元素,且原子半径依次增大.请填空:
(1)W,Z是形成化合物种类最多的两种元素,写出Z原子的核外电子排布图;
(2)化合物YW3极易溶于水的原因;YW3的分子构型为 . YW3属于(填“极性”或“非极性”)分子,其中Y的化合价为 .
(3)元素T的原子中电子共占据了7个轨道,则T在元素周期表周期族.T的化合物TY熔融时不导电,常用作砂轮及耐高温材料,由此推知,它属于(填编号字母);
a.离子晶体 b.原子晶体 c.分子晶体 d.无法判断
(4)M3+的3d轨道为半充满,则M的原子的电子排布式为 , M位于周期表的区(按电子的填入顺序划分),M的晶体中的粒子采用的是体心立方堆积,则该种堆积方式的配位数为 , 若其晶胞的边长为acm,M的摩尔质量为Mr g/mol,阿伏加德罗常数的值为NA , 则其密度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 医用酒精的浓度通常是95%
B. 蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素
C. 淀粉、纤维素和油脂都属于天然高分子化合物
D. 合成纤维和光导纤维都是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
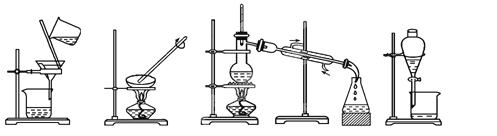
① ② ③ ④
从海水中提取水:____________;从KCl溶液中获取KCl晶体:____________;
分离CaCO3和水:____________;分离植物油和水:____________。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
实验① | 实验② | 实验③ | |
取甲瓶溶液的量 | 400 mL | 120 mL | 120 mL |
取乙瓶溶液的量 | 120 mL | 440 mL | 400 mL |
生成沉淀的量 | 1.56 g | 1.56 g | 3.12 g |
①甲瓶溶液为________溶液。
②乙瓶溶液为________溶液,其物质的量浓度为________mol·L-1。
【答案】 ③ ② ① ④ AlCl3 NaOH 0.5
【解析】(1)水易挥发,海水中提取水可用蒸馏的方法,答案选③;从 KCl溶液中获取KCl晶体,可用蒸发的方法,答案选②;CaCO3不溶于水,分离CaCO3和水,可用过滤的方法,答案选①;植物油和水互不相溶,分离植物油和水,可用分液的方法,答案选④;
(2)氯化铝滴入NaOH溶液中,开始氢氧化钠过量,发生反应AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,然后发生反应:3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl;氢氧化钠溶液滴入AlCl3溶液中,开始发生反应:AlCl3+3NaOH═Al(OH)3↓+3NaCl,然后发生反应:Al(OH)3+NaOH═NaAlO2+2H2O,由②和③可知,一定量的甲与乙反应时,乙的量越多,生成的沉淀越少,则乙为NaOH溶液,即甲为AlCl3溶液,乙为NaOH溶液,由实验①②可知,实验①中NaOH不足,AlCl3有剩余,根据AlCl3+3NaOH═Al(OH)3↓+3NaCl,1.56g沉淀的物质的量为![]() =0.02mol,则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为0.06mol/0.12L=0.5mol/L。
=0.02mol,则NaOH的物质的量为0.02mol×3=0.06mol,故NaOH溶液的物质的量浓度为0.06mol/0.12L=0.5mol/L。
【题型】综合题
【结束】
18
【题目】(1)向AlCl3溶液中,滴加少量NaOH溶液,现象是________________________
继续滴加NaOH溶液至过量,现象是_______________。
(2)钠与水反应的离子方程式为_______________,该反应中氧化剂是_______________,产生1mol H2时,转移电子的物质的量为_______________mol。
(3)经常有人因误食亚硝酸钠(NaNO2)而中毒。原因是NaNO2像食盐一样既有咸味,又有很强毒性。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O
①该反应的氧化剂是_______,被氧化的是_________元素。
②若此反应中电子转移数目为0.5mol,则被氧化的还原剂的物质的量为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com