
【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质 | 实际应用 | |
A. | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
B. | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
C. | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
D. | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
A.向NaAlO2溶液中通入足量CO2,有白色沉淀产生,说明碳酸的酸性强于氢氧化铝
B.用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+
C.在KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去,说明SO2具有漂白性
D.向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
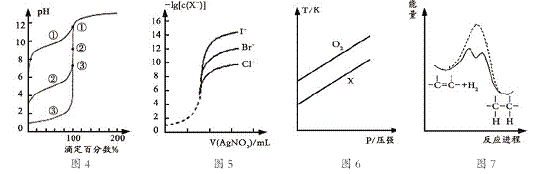
A. 用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图4曲线确定①的酸性最强
B. 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图5曲线,可确定首先沉淀的是Cl-
C. 在体积相同的两个密闭容器中,分别充入相同质量O2和X气体,由图6可确定X可能是CH4气体
D. 由图7可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
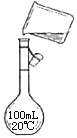
【题目】分实验室用氢氧化钠固体配制1.0 mol·L-1的NaOH溶液250mL,回答下列问题:
(1)实验仪器:托盘天平、药匙、烧杯、玻璃棒、(量筒)、 。
(2)实验步骤:①计算:②称量,③溶解,④移液,⑤洗涤,⑥ ⑦摇匀。称量所需氯化钠的质量为 g。
(3)下列操作使所配溶液的浓度偏大的有________;
A.托盘天平的托盘放上纸称量NaOH |
B.未洗涤溶解NaOH的烧杯 |
C.溶解后未冷却就立即转移到容量瓶中 |
D.定容时俯视刻度线 |
E.摇匀,静置后发现液面不到刻度线,再加水至刻度线
F.容量瓶未干燥即用来配制溶液
(4)右图是实验步骤④的示意图,图中的错误是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一恒容密闭容器中充入2mol SO2和1mol O2,在一定条件下发生反应:2SO2+O2![]() 2SO3下列有关说法正确的是( )
2SO3下列有关说法正确的是( )
A.达到化学平衡时,正反应和逆反应的速率都为零
B.当O2的浓度不变时,反应达到平衡状态
C.当单位时间消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态
D.当SO2、O2、SO3的分子数比为2:1:2,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某学生实验小组用50mL0.50molL﹣1的盐酸与50mL0.50molL﹣1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定
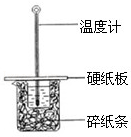
①图中装置缺少的一种仪器,该仪器名称为 .
②将反应混合液的 温度记为反应的终止温度.
③下列说法正确的是 .
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
C.烧杯间填满碎纸条的作用是固定小烧杯
D.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅.
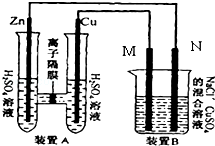
(2)如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加 g;此时,所有电极上总共收集到的气体的总体积为 L(换算成标准状况下的体积).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )

A. 铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+
B. 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )

A. N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g);△H=2(b-a)kJ·mol-1
C. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(1);△H=(h+c-a)kJ·mol-1
H2(g)=NH3(1);△H=(h+c-a)kJ·mol-1
D. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g);△H=(a+b)kJ·mol-1
H2(g)=NH3(g);△H=(a+b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.22.9 | 2.83.1 | 2228 | 6065 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

(1) “酸浸”时V2O5转化为VO2+,反应的离子方程式为 ,同时V2O4转成VO2+,“废渣1”的主要成分是 。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为 mol。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中。“废渣2”中含有 。
(4)“离子交换”和“洗脱”可简单表示为:4R0H+ V40124-![]() R4V4O12+4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈 性 (填“酸”“碱”“中”);“流出液”中阳离子最多的是 。
R4V4O12+4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈 性 (填“酸”“碱”“中”);“流出液”中阳离子最多的是 。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com