
【题目】下列关于S、SO2、H2SO4的叙述中,正确的是
A.硫是一种易溶于水的黄色晶体 B.SO2溶于水生成H2SO4
C.用氢氧化钠溶液处理含有SO2的尾气 D.浓H2SO4不稳定,光照易分解
科目:高中化学 来源: 题型:
【题目】硫及其化合物在工业上有着广泛的应用.
完成下列填空:
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式 .
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下:
Mn2++S2O82﹣+H2O→ MnO4﹣+SO42﹣+H+
配平该反应方程式,氧化产物是 .
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在(填:“阳极”或“阴极”)反应生成S2O82﹣ , 另一极生成氢气,生成0.1mol的S2O82﹣同时可收集到 g氢气.
(4)已知硫酸的第二级电离并不完全:HSO4﹣![]() H++SO42﹣(Ki=1.2×10﹣2);
H++SO42﹣(Ki=1.2×10﹣2);
在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是 , 第4位的离子是 . 往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中 ![]() (填:“增大”、“减小”或“不变”)
(填:“增大”、“减小”或“不变”)
(5)已知:HSO3﹣H++SO32﹣,K=1.02×10﹣7
NH4++H2ONH3H2O+H+ , K=5.65×10﹣10
往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是(选填编号).
a.HSO3﹣+Ba2++OH﹣→BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣→2BaSO3↓+2H2O+NH3H2O
c.NH4++HSO3﹣+Ba2++2OH﹣→BaSO3↓+H2O+NH3H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣→3BaSO3↓+4H2O+2NH3H2O+SO32﹣ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是以电解饱和食盐水为原理的重要化工生产业.
(1)电解饱和食盐水的化学方程式是
(2)电解时阳极区溶液的pH用盐酸控制在2~3,用化学平衡移动原理解释盐酸的作用;
(3)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42﹣等杂质.某次除杂操作时,往粗盐水中先加入过量的(填化学式),至沉淀不再产生后,再加入过量的(填化学式)和NaOH,充分反应后将沉淀一并滤去.经检测发现滤液中仍含有一定量的SO42﹣ , 解释其原因[已知:Ksp(BaSO4)=1.1×10﹣10、Ksp(BaCO3)=5.1×10﹣9].
(4)食盐水中若含有NH4+ , 会在阳极产生难溶于水的NCl3 , 写出该电极反应式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是( ) 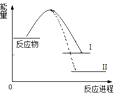
A.1molN≡N键能与3molH﹣H键能之和大于6molN﹣H键能,所以反应为放热
B.N2(g)+3H2(g)2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1
C.选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少
D.2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( ) 
A.a、b、c三点溶液的离子浓度之和a>b>c
B.b点溶液中c(H+)+c(NH3H2O)=c(OH﹣)
C.用等浓度的NaOH溶液和等体积b、c处溶液反应,恰好反应时消耗NaOH溶液的体积Vb=Vc
D.a、b、c三点溶液中水的电离程度a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2=4NO+6H2O,若反应速率分别用ν(NH3)、ν(O2)、ν(NO)、ν(H2O)(摩/升分)表示,则正确的关系是( )
A.![]() ν(NH3)=ν(O2)
ν(NH3)=ν(O2)
B.![]() ν(O2)=ν(H2O)
ν(O2)=ν(H2O)
C.![]() ν(NH3)=ν(H2O)
ν(NH3)=ν(H2O)
D.![]() ν(O2)=ν(NO)
ν(O2)=ν(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO45H2O是铜的重要化合物,有着广泛的应用.
(1)CuSO45H2O制取
完成下列填空:
a.向含铜粉的稀硫酸中滴加少量浓硝酸(可加热),铜粉溶解时可以观察到的实验现象: .
b.根据反应原理,硝酸与硫酸的理论配比(物质的量之比)为 .
c.步骤Ⅰ;步骤Ⅱ .
(2)胆矾中CuSO45H2O含量的测定
已知:CuSO4+2NaOH→Cu(OH)2↓+Na2SO4
a.实验方案如下,并将步骤④补全:
①将12.500g胆矾样品溶解,配成100mL溶液,取25mL于烧杯中;
②向溶液中加入100mL0.2500mol/L氢氧化钠溶液使Cu2+完全沉淀(不考虑其它副反应);
③过滤,多余的氢氧化钠溶液用0.5000mol/L盐酸滴定至终点,耗用10.00mL盐酸;
④
⑤数据处理.
b.在滴定中,眼睛应注视;滴定终点时,准确读数应该是滴定管上所对应的刻度.
c.就方案中数据进行处理,则样品CuSO45H2O中质量分数为 . 步骤③中沉淀未洗涤,导致结果(填偏大、偏小、无影响).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度相同,浓度均为0.2molL﹣1的①(NH4)2SO4 , ②NaNO3 , ③NH4HSO4 , ④NH4NO3 , ⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A.③①④②⑤
B.①③⑤④②
C.③②①⑤④
D.⑤②④①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com