
 (1)现有浓度为0.1mol•-1的四种溶液①硫酸②醋酸③氢氧化钠④氯化铵.这四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①(填序号).
(1)现有浓度为0.1mol•-1的四种溶液①硫酸②醋酸③氢氧化钠④氯化铵.这四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①(填序号).分析 (1)酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大,其抑制水电离程度越大;含有弱离子的盐促进水电离;
(2)水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大;
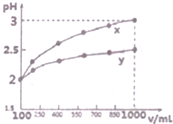
(3)25℃时,取等体积的pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8)混合,恰好完全中和,说明二者的物质的量相等,酸中c(H+)=10-x mol/L,碱中c(OH-)=10 y-14mol/L,两种溶液体积相等,所以酸中c(H+)等于碱中c(OH-);
(4)弱酸部分电离,加水稀释弱酸过程中,弱酸会继续电离出氢离子,pH相同的两种酸,稀释相同的倍数,pH变化小的是弱酸;pH相同的不同时,酸的电离程度越大其溶液浓度越小;
(5)氯化亚铁易水解生成氢氧化铁和稀盐酸,要除去MgCl2酸性溶液中少量的FeCl3,加入的物质不能引进杂质且能和氯化铁或稀盐酸反应;
(6)氯化铝是强酸弱碱盐,铝离子水解生成氢氧化铝和HCl,加热促进盐酸挥发而促进铝离子水解,蒸干溶液时得到氢氧化铝,灼烧氢氧化铝得到氧化铝.
解答 解:(1)酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大,其抑制水电离程度越大;含有弱离子的盐促进水电离,硫酸、醋酸和NaOH抑制水电离,氯化铵促进水电离,硫酸中c(H+)是NaOH中c(OH-)的2倍,醋酸中c(H+)小于氢氧化钠中c(OH-),所以这四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,故答案为:④②③①;
(2)水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,t℃,Kw=1×10-13>1×10-14,所以该温度大于25℃,故答案为:>;
(3)25℃时,取等体积的pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8)混合,恰好完全中和,说明二者的物质的量相等,酸中c(H+)=10-x mol/L,碱中c(OH-)=10 y-14mol/L,两种溶液体积相等,所以酸中c(H+)等于碱中c(OH-),所以10-x=c(OH-)=10 y-14,则x+y14,
故答案为:x+y=14;
(4)弱酸部分电离,加水稀释弱酸过程中,弱酸会继续电离出氢离子,pH相同的两种酸,稀释相同的倍数,pH变化小的是弱酸,所以y是弱酸;pH相同的不同时,酸的电离程度越大其溶液浓度越小,所以c(x)<c(y),故答案为:y;<;
(5)氯化亚铁易水解生成氢氧化铁和稀盐酸,要除去MgCl2酸性溶液中少量的FeCl3,加入的物质不能引进杂质且能和氯化铁或稀盐酸反应,MgO、Mg(OH)2、MgCO3都可以和酸反应生成氯化镁,降低溶液酸性,促进铁离子水解而生成沉淀,如果加入硫酸镁会产生杂质离子硫酸根离子,故选abc;
(6)氯化铝是强酸弱碱盐,铝离子水解生成氢氧化铝和HCl,加热促进盐酸挥发而促进铝离子水解,蒸干溶液时得到氢氧化铝,灼烧氢氧化铝得到Al2O3,故答案为:Al2O3.
点评 本题考查化学反应原理,涉及盐类水解、酸碱中和反应定性判断、弱电解质的电离等知识点,明确盐的性质、弱电解质电离特点、盐类水解原理等即可解答,注意(5)中加入碳酸镁不引进杂质,因为碳酸镁难溶于水,且碳酸镁和稀盐酸反应生成氯化镁和二氧化碳气体,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 常温下,c(H+)/c(OH-)=1010的溶液中:Na+、NH4+、ClO-、I- | |
| C. | 水电离出的c(H+)=10-12mol•L-1的溶液:K+、Na+、CO32-、Br- | |
| D. | 含有0.1mol•LHCO3-的溶液:Na+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
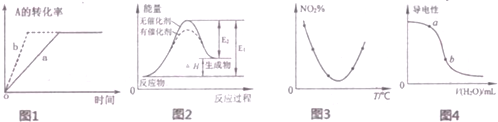
| A. | 图1所示反应:A(g)+2B(g)?3C(g),b曲线表示的一定是增大压强 | |
| B. | 图2表示催化剂能改变化学反应的焓变 | |
| C. | 图3表示等量N02在容积相同的恒容密闭容器中,不同温度下分别发生反应;2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 图4表示向稀CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最差的是Y | |
| B. | X元素形成的单核阴离子还原性强于Y | |
| C. | Z元素氧化物对应水化物的酸性强于Y | |
| D. | Y元素单质在化学反应中只表现出氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中金属铝表面迅速氧化形成保护层 | |
| B. | 钢铁在潮湿的空气中生锈 | |
| C. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| D. | 钢管被原油中的含硫化合物腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
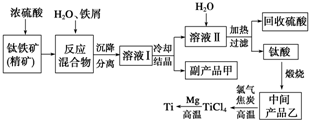 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com